Lexikon der Biochemie: Myosin
Myosin, ein hochmolekulares Protein (Mr 540 kDa), das ebenso wie Actin ein wichtiger Baustein der kontraktilen Muskelfaser (Muskelproteine) ist. M. ist aus zwei Polypeptidketten mit je 2.000 Aminosäureresten und einem globulären Kopfstück am Kettenende, bestehend aus zwei Paaren kleinerer Polypeptide (Mr 20 kDa), den sog. leichten Ketten, aufgebaut. M. besteht aus einem stäbchenförmigen Teil (150 × 2nm) und aus zwei miteinander verdrillten α-Helices, an die sich die beiden globulären Köpfe von 20 × 7nm anfügen (Abb.). In diesen Köpfen ist die ATPase-Aktivität lokalisiert und weiterhin befindet sich dort die Bindungsstelle für Actin. M. war das erste entdeckte Motorprotein. Actin und M. formen während der Muskelkontraktion temporär den Actomysin-Komplex. 200-250 parallel angeordnete Moleküle des M. bilden die dicken Filamente der Myofibrillen des Muskels (Myosinfilamente).
Durch Einwirkung der Enzyme Trypsin oder Papain entstehen zwei wasserlösliche Fragmente, die Meromyosine (MM). Unter kontrollierten Bedingungen vollzieht sich die Spaltung hauptsächlich an einem Punkt des helicalen Stiels. Dieser Punkt wird "Scharnier" (engl. hinge) genannt. Man unterscheidet das fibrilläre leichte (engl. light) LMM (Mr 140 kDa) und das globuläre schwere (engl. heavy) HMM (Mr 340 kDa). LMM besteht aus zwei, HMM aus neun Polypeptidketten. HMM besitzt eine Affinität zu Actin und wird oft dazu verwendet, die Orientierung von Actinfilamenten aufzuzeigen.
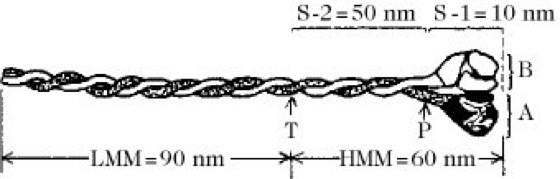
Myosin. Schema des Myosinmoleküls.
T = Angriffspunkt des Trypsins. P = Angriffspunkt des Papains, wenn es in geringer Konzentration vorliegt. LMM + S-2 = Schwanzteil. S-1 = Kopfteil.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.