Lexikon der Biochemie: Nicotinsäureamid-adenin-dinucleotid
Nicotinsäureamid-adenin-dinucleotid, NAD, Diphosphopyridinnucleotid (DPN), Codehydrogenase I, Coenzym I, Cozymase, ein Pyridinnucleotidcoenzym, das an biochemischen Redoxprozessen zahlreicher NAD-spezifischer Substrate beteiligt ist. NAD ist das Coenzym einer großen Anzahl von Oxidoreduktasen, die als pyridinabhängige Dehydrogenasen zusammengefasst werden. Sie dienen als Elektronenakzeptoren bei der enzymatischen Abspaltung der Wasserstoffatome von spezifischen Substratmolekülen.
In der oxidierten Form (NAD+; Mr 663,4Da) ist das Pyridiniumkation des Nicotinamids über eine N-glycosidische Bindung an das C1 der D-Ribose gebunden. Der Nicotinsäureamidribosidteil ist über eine Pyrophosphatbrücke mit dem Adenosin verknüpft. NAD hat daher die Struktur eines Dinucleotids (Abb. 1).
NAD kommt in zwei Formen vor, die sich in der Konfiguration der glycosidischen Bindung des Nicotinsäureamids unterscheiden: α-NAD ([α] ![]()
+14,3°) und β-NAD ([α] ![]()
-34,8°). Nur das β-NAD ist enzymatisch aktiv. Die glycosidische Bindung des Adenins besitzt sowohl im α- als auch im β-NAD die β-Konfiguration.
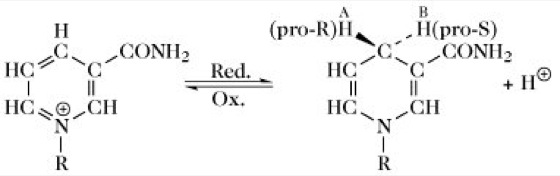
Die reversible Wasserstoffaufnahme ist an den Pyridinring des Nicotinsäureamidanteils des Coenzyms gebunden (Abb. 2). Wegen der positiven Ladung des koordinativ fünfwertigen Stickstoffs des Pyridiniumkations symbolisiert man das oxidierte NAD (NADox) exakt als NAD+. Die reduzierte Form des NAD (NADred) wird heute entsprechend den Richtlinien der Internationalen Nomenklaturkommission als NADH bezeichnet. Die Wasserstoffübertragung von einem reduzierten Substrat (Substrat-H2) auf das NAD+ einer Dehydrogenase erfolgt stereospezifisch und ist eigentlich eine Hydridübertragung. Werden 2 [H] mit einem Elektronenpaar von einem Substrat auf den Pyridinring übertragen, so wird das Pyridiniumkation unter Aufhebung seiner aromatischen Natur reduziert, und ein Proton freigesetzt: Substrat-H2 + NAD+![]()
Substrat + NADH + H+.
Eines der beiden übertragenen Wasserstoffatome wird kovalent an NAD gebunden, während das andere in ein Proton überführt wird, das mit den Protonen des wässrigen Mediums im Gleichgewicht steht.
Durch die Reduktion von NAD wird am C4 des Pyridinrings ein prochirales Zentrum eingeführt. Die Übertragung des Hydridions (ein Proton mit einem Elektronenpaar) auf NAD+ verläuft stereospezifisch, d.h. der neu eingeführte Wasserstoff nimmt entweder die pro-R- oder die pro-S-Konfiguration ein [entsprechend der älteren Nomenklatur ist der Wasserstoff entweder auf der A(α)- oder der B(β)-Seite des reduzierten Pyridinrings gebunden]. Beispielsweise übertragen die Ethanol-, Lactat- und Malat-Dehydrogenasen den Wasserstoff auf die pro-R-Position und spalten ihn auch wieder aus dieser Position ab, während 3-Phosphoglycerinaldehyd- und Glucose-Dehydrogenase pro-S-spezifisch sind.
Die oxidierte und die reduzierte Form von NAD besitzen unterschiedliche spektrophotometrische Eigenschaften. Beide zeigen eine intensive Absorptionsbande im Bereich von 260 nm, die auf das Adenin zurückzuführen ist. NADH besitzt ein breites Absorptionsmaximum bei 340 nm, das bei NAD+ nicht vorhanden ist und durch die chinoide Struktur des reduzierten Nicotinsäureamidrings verursacht wird. Daher lässt sich die Reduktion oder Oxidation von NAD relativ leicht an der Änderung der Lichtabsorption bei 340 nm verfolgen (optischer Test). Da die Absorptionsbande relativ breit ist, kann sie auch durch Wellenlängen bestimmt werden, die sich vom Maximum unterscheiden, beispielsweise können die Quecksilberlinien bei 334nm und 366nm verwendet werden. Das λmax von NAD+ (pH 7,0) liegt bei 260 nm (ε = 18.000, d.h., 1Mol in 1Liter entspricht einer Absorption von 18.000, wenn der Lichtweg 1cm beträgt). NADH weist zwei Absorptionsmaxima auf (pH 10,0), das erste bei 259nm (ε = 14.400), das zweite bei 340 nm (ε = 6.200). Bei 334nm beträgt ε = 6.000 und bei 366nm ist ε = 3.300.
In lebenden Zellen liegt NAD vorwiegend in oxidierter Form vor. So wurde z.B. für Rattenlebergewebe ein Quotient NAD+/NADH + H+ = 2,6/1 bestimmt. Allerdings sind beträchtliche Mengen des Coenzyms an Dehydrogenasen gebunden und liegen nicht in freier Form vor.
Die Biosynthese von NAD verläuft über Chinolinsäure (Pyridinnucleotid-Zyklus, L-Typtophan). Am Abbau von NAD sind verschiedene Enzyme beteiligt: NADH-Oxidase, NADH-Pyrophosphatase, NAD-Nucleosidasen u.a.
Über die Stoffwechselfunktionen des NAD Wasserstoffmetabolismus.
Zusätzlich zu seiner Funktion bei der Wasserstoffübertragung dient NAD+ bei der ADP-Ribosylierung von Proteinen als Donor der ADP-Ribosylgruppe.
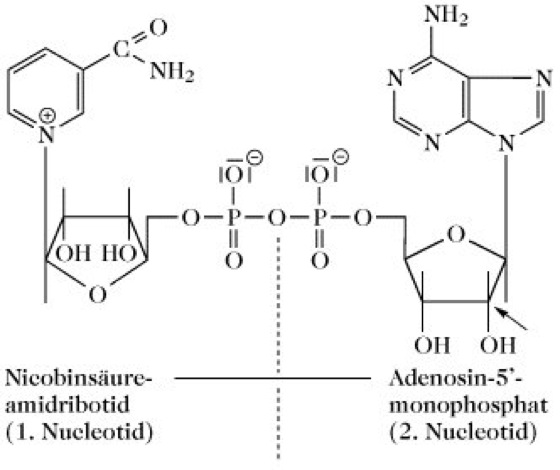
Abb. 1. Nicotinsäureamid-adenin-dinucleotid. Struktur des NAD. Im Nicotinsäureamid-adenin-dinucleotidphosphat (NADP) ist an C2 des zweiten Nucleotid (Pfeil) eine zusätzliche Phosphatgruppe vorhanden.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.