Lexikon der Biochemie: Östrogene
Östrogene, Estrogene, Follikelhormone, eine Gruppe weiblicher Sexualhormone. Die natürlichen Ö. leiten sich von Östran ab, sie haben einen aromatischen Ring A mit einer phenolischen Hydroxygruppe am C3 und eine Sauerstofffunktion am C17 (Tab.). Sie enthalten 18 Kohlenstoffatome. Hauptvertreter ist Östradiol, 1,3,5(10)-Östratrien-3,17β-diol. Daneben treten die schwächer wirksamen Metabolite Östron und Östriol auf. Die Ö. werden besonders in den Graafschen Follikeln des Ovars (daher der Name Follikelhormone) und im Gelbkörper, während der Schwangerschaft auch in der Plazenta gebildet. In geringer Menge kommen sie auch in männlichen Keimdrüsen vor. Die Biosynthese verläuft über Testosteron, dessen CH3-Gruppe am C10 als Formaldehyd eliminiert wird. Anschließend erfolgt Aromatisierung des Rings A. Die Ö. werden partialsynthetisch aus anderen Steroiden, in zunehmendem Maße aber totalsynthetisch dargestellt. Die Ö. sind für die Ausbildung der sekundären weiblichen Geschlechtsmerkmale und zusammen mit Progesteron und den Gonadotropinen für den normalen Ablauf des Menstruationszyklus verantwortlich.
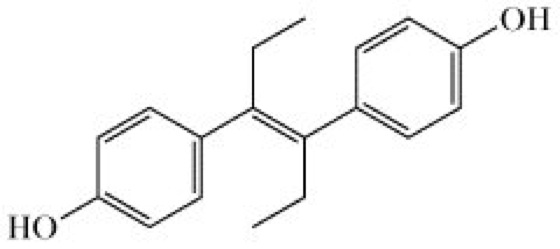
Therapeutisch finden die Ö. – meist in Kombination mit Gestagenen – zur Substitutionstherapie bei Östrogenmangelerscheinungen, z.B. bei drohendem Abort, Amenorrhoe, Dysmenorrhoe, klimakterischen Beschwerden, und als Kontrazeptiva Anwendung. Von den natürlichen Ö. kommt nur Östriol nach oraler Anwendung zur Wirkung. Wegen schneller Metabolisierung besitzt Östradiol bei parenteraler Applikation eine flüchtige und bei oraler Applikation praktisch keine Wirkung. Deshalb werden therapeutisch Ester des Östradiols für die parenterale (z.B. Östradiol-3-benzoat) und orale Applikation (z.B. Östradiol-17-valerat) verwendet. Eine sichere Wirkung bei oraler Anwendung ist bei den partialsynthetischen Ö. mit 17α-Ethinylgruppe, z.B. Ethinylöstradiol und Mestranol, gegeben. Aus diesem Grunde finden sich diese Verbindungen vorzugsweise in Kontrazeptiva. Die Einführung der 17α-Ethinylgruppe erfolgt durch Ethinylierung von Verbindungen mit Ketofunktion am C17. Eine östrogene Wirkung bei oraler Applikation zeigen auch synthetische Verbindungen vom Typ des Diethylstilböstrols, α,α'-Diethyl-4,4'-dihydroxystilben, bei denen sich die beiden Hydroxygruppen in gleicher Entfernung voneinander befinden wie beim Östradiol (Abb.). Als Depotform spielt der O,O-Dimethylether dieser Verbindung eine Rolle. Wegen zahlreicher unerwünschter Nebenwirkungen haben diese Verbindungen in der Humanmedizin nur noch geringe Bedeutung. Das Tetranatriumsalz des Di-O-monophosphorsäureesters des Diethylstilböstrols (Fosfestrol) wird zur Behandlung des Prostatacarcinoms eingesetzt.
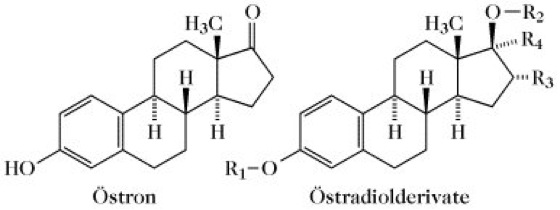
Östrogene. Tab.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.