Kompaktlexikon der Biologie: spezifische Immunantwort
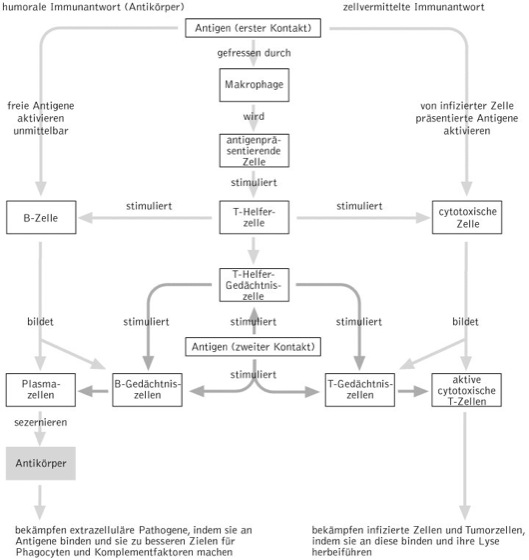
spezifische Immunantwort, das spezifische Erkennen und Unschädlichmachen von in den Körper eingedrungenen Antigenen (Mikroorganismen oder Fremdstoffe) durch das Immunsystem. Hierbei sind zwei Subsysteme wirksam, die unterschiedlich auf Antigene reagieren: das erste Subsystem ist die humorale Immunität, d.h. die Produktion von Antikörpern (Immunglobuline), die von den B-Lymphocyten sezerniert werden und als lösliche Proteine im Blutplasma und in der Lymphflüssigkeit zirkulieren; das zweite Subsystem wird zellvermittelte Immunität genannt und beruht mehr auf der direkten Wirkung von Zellen (T-Lymphocyten). Die zirkulierenden Antikörper wirken insbesondere gegen Toxine, freie Bakterien und Viren in den Körperflüssigkeiten, die T-Lymphocyten hingegen schützen gegen in Zellen eingedrungene Bakterien und Viren sowie gegen Pilze, Einzeller und Wurmparasiten; außerdem sind sie an der Bekämpfung von transplantiertem Gewebe und von Krebszellen beteiligt.
Spezifität und Diversität des Immunsystems und damit der Immunantwort sind abhängig von Rezeptoren auf den B- und T-Lymphocyten, die diese Zellen in die Lage versetzen, ein bestimmtes Antigen zu erkennen und darauf zu reagieren. Die Rezeptoren der B-Lymphocyten sind membrangebundene Antikörper und als solche spezifisch für ein bestimmtes Antigen. Diejenigen der T-Lymphocyten sind keine Antikörper, erkennen aber ihre jeweiligen Antigene genauso spezifisch. Grundsätzlich führt die Bindung eines Antigens an den spezifischen Rezeptor dazu, dass der Lymphocyt beginnt, sich zu teilen und zu differenzieren. Hieraus entsteht eine Population von Effektorzellen, die im weiteren Verlauf der Immunantwort das Antigen bekämpfen. Die Effektorzellen der humoralen Immunantwort werden als Plasmazellen bezeichnet. Im Rahmen der zellvermittelten Immunantwort entstehen zwei verschiedene Populationen von Effektorzellen, die cytotoxischen T-Zellen (TC – Zelle), die infizierte Zellen und Tumorzellen töten und die T-Helferzellen (TH – Zelle), die Cytokine abgeben, welche an der Regulation von B- und T-Zellen beteiligt sind. Die Fähigkeit des Immunsystems, auf eine unbegrenzte Vielfalt von Antigenen spezifisch reagieren zu können, beruht auf der großen Vielfalt antigenspezifischer Lymphocyten. Diese wird bereits während der Embryonalentwicklung festgelegt und durch den jeweiligen Antigen-Rezeptor nach außen vermittelt. Kommt nun ein Lymphocyt (meist ist eine ganze Lymphocytenpopulation betroffen) mit dem für ihn spezifischen Antigen in Berührung, so wird er zur Bildung einer großen Zahl (eines Klons) von Effektorzellen angeregt, die das eingedrungene Antigen spezifisch bekämpfen. Diese antigenspezifische Selektion und anschließende Bildung eines Klons von Lymphocyten wird als klonale Selektion bezeichnet. Sie bildet die primäre Immunantwort bei der ersten Begegnung mit einem Antigen und dauert bis zur maximalen Produktion von Effektorzellen etwa fünf bis zehn Tage. Wird der Organismus später erneut mit diesem Antigen konfrontiert, ist die nun folgende sekundäre Immunantwort erheblich schneller (drei bis fünf Tage) und hält länger an. Diese Fähigkeit, ein Antigen wiederzuerkennen, wird als immunologisches Gedächtnis bezeichnet. Es basiert auf langlebigen Gedächtniszellen, die zusammen mit den Effektorzellen im Rahmen der primären Immunantwort gebildet werden. Dieser Mechanismus liegt der Entwicklung einer lebenslangen Immunität nach einer Krankheit, wie z.B. Windpocken, zugrunde.
Mechanismus der humoralen Immunantwort. Die Bindung eines Antigens an einen spezifischen Rezeptor auf der Oberfläche eines B-Lymphocyten und die anschließende Proliferation von Effektorzellen ist ein Schritt der humoralen Immunantwort. Ein zweiter Schritt bezieht Makrophagen und T-Helferzellen mit ein. Hat z.B. ein Makrophage einen Fremdkörper oder Mikroorganismus durch Phagocytose aufgenommen und verdaut, werden Fragmente des Antigens von intrazellulären MHC-Klasse-II-Molekülen gebunden und der entstehende Komplex nach Integration in die Plasmamembran des Makrophagen an der Zelloberfläche präsentiert (Antigen präsentierende Zelle, Abk. APC). Kommt es zum Kontakt mit einer spezifischen T-Helferzelle, so proliferiert dieser zu einem T-Helferzellklon mit anschließender Sekretion von Cytokinen, die selektiv jene B-Lymphocyten aktivieren, die bereits mit dem Antigen Kontakt hatten und, ebenso wie der Makrophage, einige Antigenmoleküle phagocytiert hatten und Antigenfragmente, an MHC-Klasse-II-Moleküle gebunden, auf ihrer Oberfläche präsentieren. Diesen Komplex erkennt dann die T-Helferzelle. Während ein Makrophage als APC eine Vielzahl von Antigenen präsentieren kann, bindet die antigenspezifische B-Zelle lediglich einen einzigen Antigentyp; auch die T-Helferzelle ist spezifisch für einen Antigentyp.
Die von B-Lymphocyten gebildeten Effektorzellen, die Plasmazellen, produzieren in großer Menge Antikörper, die dazu dienen den Fremdkörper oder Mikroorganismus zu eliminieren. Sie binden dazu an das Antigen, und der Antigen-Antikörper-Komplex ist der Auslöser mehrerer Effektormechanismen. Einer dieser Mechanismen ist die Neutralisation, indem der Antikörper auf dem Antigen bestimmte Stellen blockiert und es damit unwirksam macht. Ein anderer Mechanismus ist die Verklumpung oder Agglutination von Bakterien durch Antikörper, die dann durch phagocytierende Zellen leichter aufgefunden werden. Ähnlich ist die Präzipitation, das Vernetzen löslicher Antigenmoleküle zu einem unbeweglichen Präzipitat, das ebenfalls phagocytiert werden kann. Einer der wichtigsten Mechanismen ist die Aktivierung des Komplementsystems durch den Antigen-Antikörper-Komplex, das Läsionen in Form von Poren in die Membran einer Fremdzelle einfügt und dadurch zu deren Lyse führt. ( vgl. Abb. )
Mechanismus der zellvermittelten Immunantwort. Die zellvermittelte Immunantwort hat zur Aufgabe, Pathogene zu bekämpfen, die bereits in Zellen eingedrungen sind. Daher antworten T-Zellen ausschließlich auf antigene Epitope, die auf der Oberfläche von körpereigenen Zellen präsentiert werden. Ein Beispiel sind die aus Antigenfragmenten und MHC-Klasse-II-Molekülen bestehenden Komplexe, die von T-Helferzell-Rezeptoren erkannt werden. Die Rezeptoren der cytotoxischen T-Zellen erkennen hingegen Antigen-MHC-Klasse-I-Molekül-Komplexe. Die Interaktion zwischen einer T-Helfer-Zelle (TH) und einer Antigen präsentierenden Zelle (APC) wird durch die Anwesenheit eines Oberflächenmoleküls mit der Bez. CD4 stark intensiviert, indem dieses die Bindung zwischen TH und APC verstärkt; eine ähnliche Funktion haben CD8-Moleküle auf der Oberfläche der cytotoxischen Zellen. Außer der Stimulation von B-Zellen zur Sekretion von Antikörpern stimulieren T-Helfer-Zellen auch andere T-Zelltypen zum Aufbau einer zellvermittelten Immunität gegen ein Antigen.
Die cytotoxischen T-Zellen (TC-Zellen) töten Zellen, die von Viren u.a. Mikroorganismen befallen sind. Dabei können cytotoxische T-Zellen an praktisch jede kernhaltige Körperzelle binden, indem sie mit MHC-Klasse-I-Molekülen assoziierte Antigene spezifisch erkennen. Bindet eine TC-Zelle an eine infizierte Zelle, setzt sie Perforin frei, ein Protein, das Poren in der Plasmamembran der Zielzelle bildet, was schließlich zur Lyse der Zelle führt; dadurch wird der in der Zelle befindliche Krankheitserreger seiner Reproduktionsstätte beraubt und außerdem den zirkulierenden Antikörpernausgesetzt. Die TC-Zelle überlebt die Zerstörung der Zielzelle und kann noch viele weitere infizierte Zellen abtöten. Auf gleiche Weise können TC-Zellen auch Krebszellen, die als fremd erkannt werden, lysieren. (Allergie und zugehöriges Essay: Allergien auf dem Vormarsch, Selbsttoleranz, unspezifische Immunantwort)
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.