Lexikon der Chemie: Borane
Borane, Borwasserstoffe, Borhydride, Bor-Wasserstoffverbindungen, von denen etwa 25 Vertreter bekannt sind und die in ihrer Zusammensetzung den allg. Formeln BnHn+4, oder BnHn+16 entsprechen. Ihre systematischen Bezeichnungen werden gebildet, indem durch ein griech. Präfix die Anzahl der Boratome und durch eine nachgestellte Zahl die der Wasserstoffatome angegeben wird. Die niederen Glieder dieser Reihen sind farblose Gase oder leichtflüchtige Flüssigkeiten von unangenehmem, übelkeitserregendem Geruch. Die höheren B. sind fest (Tab.). Der einfachste Vertreter der B. ist das Diboran B2H6 Zur Synthese von Diboran wird Bortrichlorid mit Lithiumalanat gemäß 4 BCl3 + 3 LiAlH4 → 2 B2H6 + 3 LiAlCl4 oder auch Bortrifluorid mit Natriumboranat gemäß 4 BF3 + 3 NaBH4 → 3 NABF4 + B2H6 umgesetzt. Die höheren B. werden meist durch thermische Spaltung des Diborans bei 150 bis 250 °C hergestellt, wobei die Zusammensetzung des Reaktionsgemisches vor allem von der Temperatur und vom Wasserstoffdruck bestimmt wird. Die Einwirkung von Säure auf Magnesiumborid liefert ein hauptsächlich aus Tetraboran(10) bestehendes Borangemisch.
Die Strukturen der B. werden durch die Elektronenmangelsituation bestimmt. Beispielsweise werden im Diboran die vier in einer Ebene liegenden endständigen Protonen durch "normale" σ-Beziehungen gebunden. Die Verknüpfung der beiden Boratome und Brückenwasserstoffe wird durch zwei senkrecht dazu angeordnete B-H-B-Dreizentren-Zweielektronenbindungen erreicht (Dreizentrenbindung).
-
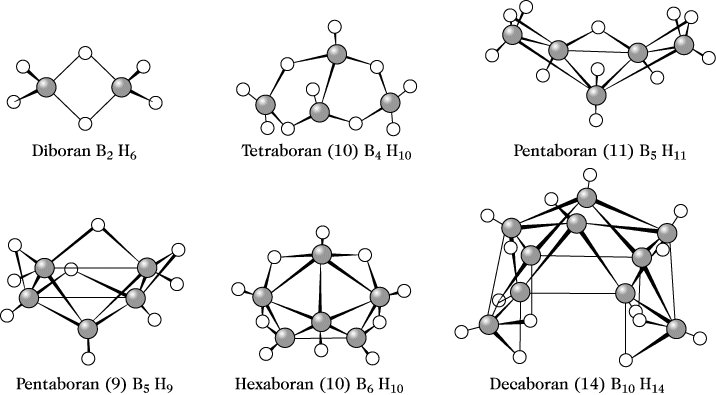
Borane. Abb.: Strukturen einiger Borane.
Ähnliche Bindungsverhältnisse findet man in den höheren B., in denen zusätzlich B-B-B-Dreizentrenbindungen auftreten. Den speziellen Strukturen der B. wird oftmals in deren Nomenklatur durch Voranstellen der Präfixe "nido" (Nest), z. B. in nido-Decaboran(14), oder "closo" (geschlossen), z. B. in closo-Dodecahydrodecaboranat(2-) (Boranate), Rechnung getragen.
Borane. Tab.: Physikalische Eigenschaften einiger Borane.
| |||||
| Diboran(6) | B2H6 | -165 | ,5 | -92 | ,5 |
| Tetraboran(10) | B4H10 | -120 | ,8 | 16 | |
| Pentaboran(9) | B5H9 | -46 | ,8 | 58 | ,4 |
| Pentaboran(11) | B5H11 | -123 | ,3 | 63 | |
| Hexaboran(10) | B6H10 | -65 | Z. | ||
| Hexaboran(12) | B6H12 | -90 | Z. | ||
| Decaboran(14) | B10H14 | 99 | ,5 | 213 |
Der Elektronenmangel in den B. ist auch für deren Reaktionsverhalten bestimmend. So werden bei Wechselwirkungen mit Elektronenpaardonatoren (Lewis-Basen), z. B. tertiären Aminen, die Dreizentrenbindungen unter Bildung normaler koordinativer Bindungen geöffnet, z. B.
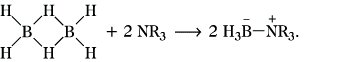
Einen analogen Verlauf nimmt die Reaktion mit Ammoniak, wobei über Zwischenstufen Borazin gebildet wird. Auch die Reaktion des Diborans mit Wasser erfolgt in diesem Sinne, wobei nachfolgend unter Eliminierung von Wasserstoff Borsäure resultiert: B2H6 + 6 H2O → 2 B(OH)3 + 6 H2. Die Reaktion mit ionischen Hydriden der Alkali- und Erdalkalimetalle oder verschiedenen Metallorganylen zu Metallboranaten kann man ebenfalls auf dieser Basis diskutieren (Boranate).
Die niederen B. sind an der Luft pyrophor und verbrennen zu Bortrioxid und Wasser, z. B. B2H6+ 3 O2 → B2O3 + 3 H2O. Durch Thermolyse werden die B. ineinander umgewandelt. Die Addition von Diboran an C=C-Doppel- und C≡C-Dreifachbindungssysteme hat präparative Bedeutung zur Herstellung bororganischer Verbindungen (Hydroborierung).
Die B. haben bei der Entwicklung des Verständnisses für die Struktur von Elektronenmangelverbindungen eine bedeutende Rolle gespielt. Praktische Verwendung finden sie als Ausgangsmaterialien zur Herstellung von Boranaten und in der Hydroborierung.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.