Lexikon der Chemie: Energiebändermodell
Energiebändermodell, Bändermodell, quantenmechanische Beschreibung der Elektronenzustände besonders im metallischen Festkörper durch Molekül- (Kristall-)Orbitale, deren Energiewerte in dicht besetzten Bändern gruppiert sind. Durch Kombination der großen Anzahl (N ≈ 1023) von verfügbaren äquivalenten Atomorbitalen im Metallkristall entstehen ebensoviele Molekülorbitale, die über den gesamten Kristall delokalisiert sind. Die zugehörigen Energieniveaus sind so dicht benachbart, daß sie experimentell nicht voneinander unterschieden werden können. Sie werden daher zu einem Energieband zusammengefaßt. Die Stärke der Wechselwirkung zwischen den jeweils äquivalenten Atomorbitalen und damit die Breite des Energiebandes hängt wesentlich vom Kernabstand der Atome im Gitter ab. Die Besetzung der Niveaus in den Energiebändern erfolgt unter Berücksichtigung des Pauli-Prinzips. Durch Kombination der jeweils äquivalenten Valenzorbitale der Atome des Kristalls entstehen Energiebänder, die für die einzelnen Stoffe eine charakteristische Breite und Anordnung aufweisen. Man unterscheidet zwischen dem teilweise bzw. vollständig mit Elektronen besetzten Valenzband und dem leeren Leitungsband (Abb.). Für Metalle ist charakteristisch, daß sich Valenz- und Leitungsband überlagern. Bei Isolatoren und Halbleitern existiert zwischen beiden Bändern eine verbotene Zone. Diese weist bei Halbleitern im Vergleich zu den Isolatoren eine deutlich geringere Breite auf, so daß bei Halbleitern durch thermische Anregung Elektronen vom Valenz- in das Leitungsband gelangen können. Somit kann mit Hilfe des E. die unterschiedliche Leitfähigkeit der Stoffe erklärt werden. Durch Zusatz (Dotierung) bestimmter Fremdatome kann in einem Halbleiter die Leitfähigkeit erhöht werden. Dotiert man z. B. Silicium mit Atomen der III. bzw. V. Hauptgruppe des Periodensystems, so resultieren dadurch innerhalb der verbotenen Zone Akzeptor- bzw. Donatorniveaus, die eine zusätzliche Störstellen- bzw. Fremdleitung bewirken.
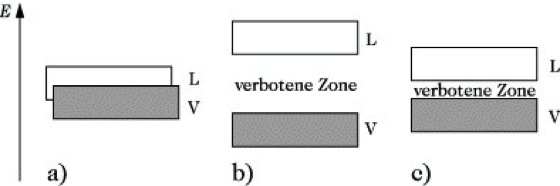
Energiebändermodell. Abb.: Energiebänderdiagramm eines (a) Metalls mit gefülltem Valenzband, (b) eines Isolators, (c) eines Halbleiters. V Valenzband, L Leitungsband.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.