Lexikon der Chemie: Aluminium
Aluminium, Symbol Al, chem. Element aus der III. Hauptgruppe des Periodensystems, der Bor-Aluminium-Gruppe, Leichtmetall, Reinelement; Z 13, Atommasse 26,98154, Wertigkeit III, sehr selten I, D. 2,702 g cm-3, F. 660,37 °C, Kp. 2467 °C, elektrische Leitfähigkeit 40 Sm/mm2 (bei 0 °C), Standardelektrodenpotential (Al/Al3+) -1,706 V.
Eigenschaften. A. ist ein silberweißes, relativ weiches, dehnbares Metall, das in kubisch-flächenzentriertem Gitter kristallisiert. Es läßt sich leicht zu dünnen Folien auswalzen und zu Draht ziehen. A. ist ein sehr guter Wärmeleiter, seine elektrische Leitfähigkeit beträgt etwa 65 % von der des Kupfers.
A. tendiert zur Abgabe seiner drei Valenzelektronen und zur Bildung farbloser Al3+-Kationen. Infolge der hohen positiven Ladung sind diese in Wasser stark hydratisiert. Auch feste Aluminiumsalze enthalten deshalb oft [Al(H2O)6]3+-Kationen. A. bildet an der Luft eine festhaftende Oxidschicht (Passivität), weshalb die ausgeprägte Reduktionswirkung häufig vermindert wird. Durch Behandlung mit Oxidationsmitteln oder auf elektrolytischem Wege (Eloxalverfahren) kann diese Oxidschicht verstärkt und damit die Korrosionsbeständigkeit verbessert werden. So behandeltes A. ist stabil gegenüber Luft, Wasser, Säuren (auch Salpetersäure) und schwachen Basen. Ohne Oxidschicht reagiert das A. rasch mit Luft oder Wasser zu Aluminiumoxid und Wasserstoff. In starken Säuren oder Basen löst sich A. unter Wasserstoffentwicklung: Al + 3 H3O+ → Al3+ + 3/2 H2 + 3 H2O; Al + OH- + 3 H2O → [Al(OH)4]- + 3/2 H2. Feinverteiltes A. verbrennt beim Erhitzen zu Aluminiumoxid: 4 Al + 3 O2 → 2 Al2O3. Die hohe Bildungstendenz des Aluminiumoxids wird in der Technik genutzt, indem z. B. in geschmolzenem Eisen gelöste Oxide durch zugesetztes A. reduktiv entfernt werden (Desoxidation). Auch zur Darstellung zahlreicher Metalle aus deren Oxiden wird A. eingesetzt (aluminothermisches Verfahren). Mit den Halogenen verbindet sich A. in exothermer Reaktion zu den Aluminiumhalogeniden (AlF3, AlCl3 usw.), die vor allem aus strukturchem. Sicht, aber auch wegen ihrer Lewis-Säure-Aktivität (Säure-Base-Konzept) Interesse verdienen.
Analytisches. Qualitativ wird A. durch Fällung als Farblack in der Ammoniumsulfidgruppe oder durch Glühen von Aluminiumhydroxid Al(OH)3 in Gegenwart von Cobalt(II)-nitrat Co(NO3)2 als CoAl2O4 (Thénards Blau) nachgewiesen. Die quantitative Bestimmung erfolgt durch komplexometrische Rücktitration mit EDTA.
Vorkommen. A. ist mit 8,1 % am Aufbau der Erdkruste beteiligt und damit nach Sauerstoff und Silicium das dritthäufigste Element und vor dem Eisen das häufigste Metall. Es kommt stets gebunden in Form verschiedener Feldspate, Glimmer, Tone und als Bauxit vor. Die wichtigsten Minerale sind Orthoklas (Kalifeldspat) K(AlSi3O8), Albit (Natronfeldspat) Na(AlSi3O9), Anorthit (Kalkfeldspat) Ca(Al2Si2O8.), Muskovit (Kaliglimmer) KAl2(AlSi3O10)(OH,F)2, Kryolith Na3AlF6. Durch Verwitterung feldspalthaltigen Gesteins bilden sich Tone unterschiedlicher Zusammensetzung. Mit Siliciumdioxid und Eisenoxid verunreinigte Tone bezeichnet man als Lehm, Calcium- oder Magnesiumcarbonat enthaltende Tone als Tonmergel. Kaolin, Al2O3·2 SiO2·2 H2O ist Ausgangsmaterial zur Porzellangewinnung. Als reines Aluminiumoxid kommt A. in Form des Korunds, der durch Verunreinigungen mit Chromoxid (Rubin) oder mit Titanoxid (Saphir) gefärbt sein kann, oder auch als Schmirgel vor.
A. ist auch in pflanzlichem und tierischem Gewebe enthalten, verhält sich aber physiologisch weitgehend indifferent.
Die Gewinnung des A. erfolgt auf der Basis oxidischer Rohstoffe. Aufgrund der hohen Sauerstoffaffinität des A. wird die Gewinnung durch Elektrolyse einer Kryolith-Tonerde-Schmelze vorgenommen, in der das A. die edelste Metallkomponente ist. Die Reinmetallreduktion erfolgt in zwei Stufen: Herstellung von reinem Al2O3 (Aluminiumoxid, Tonerde) und Schmelzflußelektrolyse von Al2O3 in geschmolzenem Kryolith (Natriumfluoroaluminat) Na3AlF.
Herstellung der Tonerde. In den meisten Betrieben wird reine Tonerde durch nassen Aufschluß der Rohstoffe nach dem Bayer-Verfahren erzeugt (Abb. 1). Dabei werden die Al-Verbindungen des Rohstoffs Bauxit in kontinuierlich betriebenen Autoklavenbatterien bei 160 bis 240 °C unter einem Druck von 0,8 MPa nach Al(OH)3 + NaOH ![]()
Na+ + [Al(OH)4]- in Natronlauge mit 200 bis 350 g Na2O/1 gelöst, so daß ein Na2O : Al2O3-Verhältnis von 1,7 vorliegt. Fe2O3 löst sich unter den Aufschlußbedingungen nicht, und SiO2 wird in unlösliches Natriumalumosilicat (Sodalith) umgewandelt (NaOH und Al2O3-Verluste). Die Aufschlußlösung wird auf 100 °C abgekühlt und verdünnt (100 bis 140g Na2O/l). Der Löserückstand (Rotschlamm) wird durch Eindicker und Filter abgetrennt, die klare Lösung auf 60 °C gekühlt und mit Hydrargillit Impfkristallen (γ-Al(OH)3) versetzt. Das während dem 30- bis 70stündigem Rühren ausgefallene Al(OH)3 wird durch Filtration von der Mutterlauge getrennt. 80 % des Al(OH)3 wird zum Impfen der Aufschlußlösung verwendet, der Rest in Öfen getrocknet und bei 1200 bis 1300 °C zum α-Al2O3 calciniert.
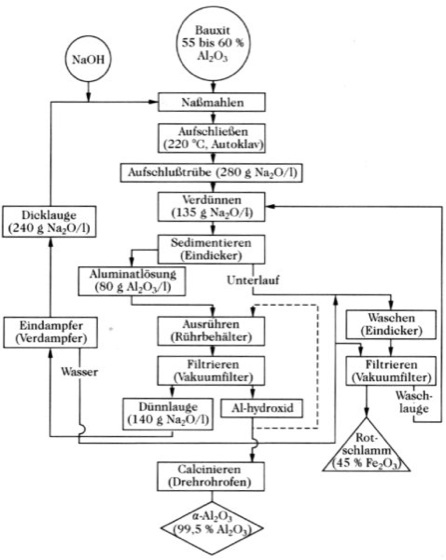
Aluminium. Abb. 1: Schema zur Herstellung von Tonerde nach dem Bayer-Verfahren.
Nichtbauxitische SiO2-reiche Rohstoffe (Tone, Alunit, Nephelin u. a.) lassen sich aufgrund der Bildung von Hydroxylsodalith 3 Na2O·3 Al2O3·6 SiO2·2 NaOH nicht nach dem Bayer-Verfahren zu reinem Al2O3 umwandeln. Durch basischen Aufschluß bei hohen Temperaturen kann das SiO2 an CaO gebunden werden, oder es wird beim Aufschluß mittels Mineralsäuren aus den Rohstoffen gelöst.
Vor Anwendung der sauren Aufschlußverfahren muß der Kaolinit durch thermische Zersetzung bei 750 °C in säurelöslichen Metallkaolinit Al2O3·2 SiO2 überführt werden. Mit Al2O3 gehen die eisenhaltigen Verunreinigungen der Rohstoffe in Lösung. Obwohl die Wiedergewinnung der Aufschlußsäure und die korrosive Belastung der Apparate problematisch sind, wird der saure Aufschluß aufgrund der Rohstoffsituation an Bedeutung gewinnen. Vorteile des Schweflige-Säure-Verfahrens liegen in der leichten Zersetzbarkeit des Aluminiumsulfits und in der Kreislauffahrweise für das SO2, das Rohaluminiumhydroxid wird nach dem Bayer-Verfahren weiterverarbeitet.
Schmelzflußelektrolyse. Da die Schmelzflußelektrolyse von reinem Al2O3 zu hohe Temperaturen erfordert, wird eine Schmelze aus synthetischem Kryolith Na3AlF6 als Elektrolyt verwendet, in dem 5 % Al2O3 gelöst sind. Damit läßt sich die Elektrolyse bei 950 bis 980 °C durchführen. Der schmelzflüssige Kryolith komplexiert das Al2O3 nach Al2O3 + [AlF6]3- → 3 (AlOF2)- und transportiert den Strom. Die elektrolytische Zersetzung führt zu A. an der Kathode und zu Sauerstoff an der C-Anode, der an den flachen Kohlenstoffwannen zu CO2 reagiert. Vereinfacht lassen sich folgende Elektrodenprozesse formulieren: 8 AlF3 + 12 e- → 4 Al + 4 [AlF6]3-, 2 Al2O3 + 4 [AlF6]3- + 3 C – 12 e- → 3 CO2 + 8 AlF3.
Die von oben in die Schmelze getauchten Anoden bestehen aus vorgebrannten Kohleblöcken oder selbstbrennenden Söderberg-Elektroden (Abb. 2). Die praktische Zersetzungsspannung beträgt 1,7 V. Das am Boden der Elektrolysewanne (Kathode) liegende, abgeschiedene flüssige A. wird abgesaugt und vergossen oder umgeschmolzen. Das Hüttenaluminium weist einen Reinheitsgrad von 99,9 % Al auf.
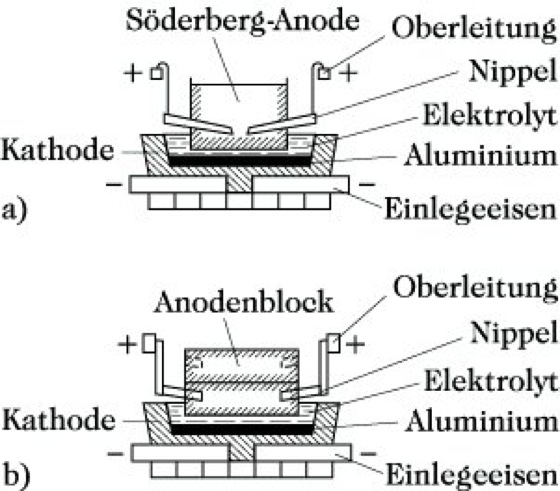
Aluminium. Abb. 2: Elektrolysezellen für die Aluminumgewinnung durch Schmelzflußelektrolyse: (a) mit Söderberg-Anoden, (b) mit vorgebrannten kontinuierlichen Blockanoden.
Reinstaluminium mit mehr als 99,99 % Al wird durch Dreischichtenelektrolyse bei 750 °C hergestellt.
Verwendung. Geringe Dichte, günstige mechanische Eigenschaften, gute Wärmeleitfähigkeit, einfache Verformbarkeit und hinreichende Korrosionsbeständigkeit machen A. zu einem wertvollen Werkstoff zur Herstellung von Apparaturen, Armaturen, Behältern u. dgl. sowie für den Fahrzeug- und Flugzeugbau. Seine Ungiftigkeit erlaubt die Verwendung von A. in der Nahrungsmittelindustrie, und aufgrund seiner hohen elektrischen Leitfähigkeit wird es beim Bau elektrischer Anlagen und bei der Verwendung in Kabeln, als Draht u. a. genutzt. Im Vakuum auf Glas aufgedampftes A. bildet ausgezeichnet reflektierende Schichten für Licht- und Wärmestrahlung. Dies wird z. B. zur Herstellung von Spiegelteleskopen genutzt. Aluminiumpulver wird zur Bereitung rostschützender Anstriche und für pyrotechnische Artikel verwendet, Aluminiumgrieß dient in der Metallurgie zur Gewinnung verschiedener Metalle nach dem aluminothermischen Verfahren.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.