Lexikon der Chemie: Fluoreszenz
Fluoreszenz, eine Form der Lumineszenz, bei der die Anregung durch Absorption von Photonen (Photolumineszenz) erfolgt. Sie stellt formal die Umkehr der Lichtabsorption dar, indem eine Desaktivierung angeregter Elektronenzustände durch Reemission der Anregungsenergie als Strahlung erfolgt. Man kann zwischen optischer F. und Röntgenfluoreszenz unterscheiden, je nachdem, ob die emittierte Strahlung im Ultraviolett und Sichtbaren oder im Röntgengebiet liegt. Die Fluoreszenzstrahlung, die innerhalb von 10-9 bis 10-6 s nach der Anregung abgegeben wird, hat entweder die gleiche Energie (Resonanzfluoreszenz) oder eine geringere Energie als die einfallende Strahlung (Stokessche Regel). Von der F. ist die Phosphoreszenz zu unterscheiden, die eine größere Abklingdauer (> 10-4 s) aufweist. F. kann bei festen, flüssigen und gasförmigen anorganischen und organischen Stoffen auftreten. Die Anzahl der fluoreszierenden anorganischen Verbindungen (Fluorit, Uraniumverbindungen, Verbindungen der Seltenerdmetalle, gasförmige Proben von Alkalimetallen u. a.) ist relativ begrenzt. Viel häufiger fluoreszieren organische Verbindungen.
Zur Charakterisierung des Fluoreszenzlichtes können folgende Parameter herangezogen werden: 1) Die spektrale Zusammensetzung des Fluoreszenzlichtes (Fluoreszenzspektrum). Sie kann zur Identifizierung und Strukturaufkärung einer Probe herangezogen werden (Fluoreszenzspektroskopie). 2) Die Intensität des Fluoreszenzlichtes. Sie kann zur Konzentrationsbestimmung fluoreszierender Substanzen benutzt werden (Fluorometrie oder Fluoreszenzphotometrie). Wegen konzentrationsabhängiger Desaktivierungsprozesse ist für quantitative Bestimmungen die Verwendung von Eichkurven erforderlich. 3) Die Abklingzeit, d. i. die Zeit, die nach Beendigung der Anregung bis zum Abfall der Intensität auf 1/e vergangen ist. Das Abklingen der F. erfolgt nach einer Exponentialfunktion. 4) Der Polarisationsgrad der F. Er kann bei der Bestrahlung einer orientierten Probe mit polarisiertem Licht beobachtet werden.
Die wichtigsten Anwendungen der F. sind die Atomfluoreszenz (Atomfluoreszenzspektroskopie), die Röntgenfluoreszenz sowie die Molekülfluoreszenz. Der Zusammenhang zwischen Absorptions- und Fluoreszenzspektren von Molekülen ist aus Abb. 1 ersichtlich.

Fluoreszenz. Abb. 1: Energiezustandsdiagramm zur Erläuterung der Fluoreszenz.
Die Absorption von Licht führt vom untersten Schwingungsniveau des elektronischen Grundzustandes S0 zu einem Schwingungsniveau des ersten angeregten Elektronenzustandes S1 oder zu höher angeregten Elektronenzuständen S2, S3 usw. Durch strahlungslose Prozesse (farbige Pfeile) erfolgt in der Regel eine Desaktivierung dieser Zustände zum niedrigsten Schwingungsniveau von S1. Lichtemission durch F. erfolgt von diesem Energieniveau in eines der Schwingungsniveaus des Elektronengrundzustandes. Demzufolge ist das Fluoreszenzlicht längerwellig als die absorbierte Strahlung, Absorptions- und Fluoreszenzbanden verhalten sich annähernd wie Bild und Spiegelbild (Abb. 2).
Desaktivierungsmöglichkeiten, die mit der F. konkurrieren können, sind neben der Abführung der Anregungsenergie durch Stöße 2. Art sowie durch Induktion photochem. Reaktionen insbesondere intramolekulare Desaktivierungsprozesse wie Prädissoziation (Spaltung schwacher Bindungen durch die Anregungsenergie) sowie Umwandlung der Elektronenanregungsenergie in Schwingungsenergie.
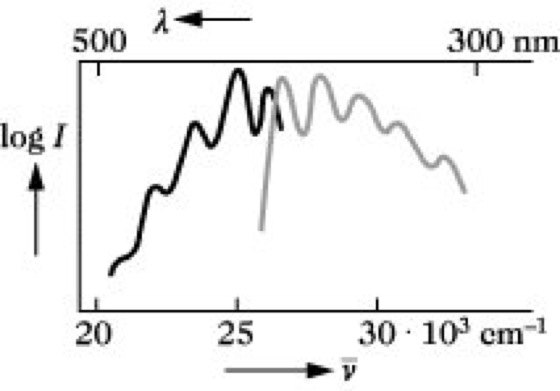
Fluoreszenz. Abb. 2: Absorptionsspektrum (schwarz) und Fluoreszenzspektrum (grau) von Anthracen. λ Wellenlänge, ν~ Wellenzahl, I Intensität.
Die Kenntnis der Fluoreszenzspektren ist von großer Bedeutung für die Theorie der angeregten Zustände (Photochemie). Verschiedene Anwendungen der F. basieren auf ihrer extrem niedrigen Nachweisgrenze. So dienen wäßrige Lösungen von Fluorescein, einer besonders stark fluoreszierenden Substanz, als Wasserzusatz bei der Lecksuche oder zur Markierung von Unglücksstellen im Seerettungsdienst.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.