Lexikon der Chemie: Osmose
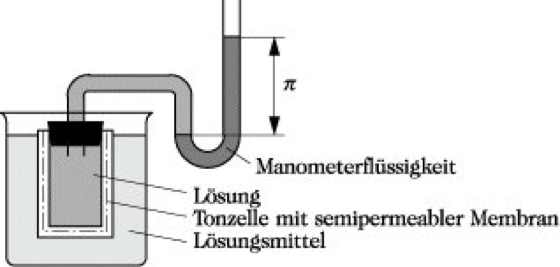
Osmose, der Durchtritt einer Flüssigkeit durch eine halbdurchlässige (semipermeable) Membran, wenn auf beiden Seiten dieser Membran zwei Lösungen unterschiedlicher Konzentration oder eine Lösung und das reine Lösungsmittel angrenzen. Als Membran können Folien von Hochpolymeren, tierische Häute, Pergament oder Zellmembranen dienen. Der Durchtritt der Flüssigkeit erfolgt in Richtung der konzentrierteren Lösung und führt dort bei abgeschlossenen Anordnungen zu einer Druckerhöhung. Der Gleichgewichtsdruck wird osmotischer Druck π genannt.
Das Membrangleichgewicht ist eingestellt, wenn die chem. Potentiale des Lösungsmittels auf beiden Seiten gleich sind. Betrachtet man den Fall einer Lösung im Gleichgewicht mit dem reinen Lösungsmittel, gilt für das chem. Potential des reinen Lösungsmittels μ01 und für das Lösungsmittel in der Lösung μ1 = μ1σ + RTlna1 + V1Δp. Dabei ist a1 die Aktivität des Lösungsmittels, V1 sein Molvolumen und Δp die Druckdifferenz zwischen beiden Seiten. Die Gleichgewichtsbedingung μ10 = μ1 erfordert Δp = π = -(RT/V1)lna1. In ideal verd. Lösungen wird a1 gleich dem Molenbruch x1. Näherungsweise kann ln x1 ≈ -x2 ≈ -c2V1 gesetzt werden, wobei x2 und c2 den Molenbruch bzw. die Konzentration des gelösten Stoffes bezeichnen (Zusammensetzungsgrößen). Daraus ergibt sich das Gesetz für den osmotischen Druck ideal verd. Lösungen von Nichtelektrolyten π = c2RT (van't-Hoffsche-Gleichung). Der osmotische Druck einer Lösung, die im Gleichgewicht mit dem reinen Lösungsmittel steht, ist nicht von der Art des gelösten Stoffes oder des Lösungsmittels abhängig. Für eine 1 M Lösung folgt ein osmotischer Druck π = 2,48 MPa (= 24,5 atm). Da c2 = m2/M2V ist, kann die Messung des osmotischen Druckes zur Molmassebestimmung verwendet werden, vor allem für makromolekulare Verbindungen .
Die O. gehört zu den kolligativen Eigenschaften, d. h., die Größe der Effekte ist nicht von der Konzentration, sondern von der effektiven Zahl gelöster Teilchen abhängig. Assoziation und Dissoziation der gelösten Stoffe führen zu einer Veränderung der Teilchenzahl. Bei schwachen Elektrolyten kann die Teilchenzahlvergrößerung durch Einführung des Dissoziationsgrades α über den van't-Hoffschen Faktor i = 1 + (ν – 1)α berücksichtigt werden (Raoultsches Gesetz), wobei ν die Zahl der Ionen angibt, in die ein Elektrolyt zerfällt. Es folgt π = ic2RT. Oft treten Abweichungen auf, weil die Voraussetzung einer idealen Lösung nicht mehr erfüllt ist. Deshalb wird ein osmotischer Koeffizient f0 = πreal/πideal eingeführt, der mit dem Aktivitätskoeffizienten f1 des Lösungsmittels durch die Beziehung f0 = 1 + lnf1/lnx1 verknüpft ist.
Die O. ermöglicht den Stofftransport im tierischen und pflanzlichen Organismus sowie einen inneren Spannungszustand der Pflanze (Turgor).
Man unterscheidet hypertonische, isotonische und hypotonische Lösungen, die sich darin unterscheiden, ob sie einen höheren, gleichen oder niedrigeren osmotischen Druck als eine mit ihnen im Gleichgewicht stehende Zelle haben. Hypertonische Lösungen führen zum Quellen der Zelle durch Wasseraufnahme, hypotonische Lösungen zum Schrumpfen. Das menschliche Blut hat einen osmotischen Druck von 0,78 MPa. Die zum Blut isotonische physiologische Kochsalzlösung enthält 0,9 bis 1 Masse-% Natriumchlorid.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.