Lexikon der Chemie: Phosphate
Phosphate, 1) die Salze der Phosphorsäuren, im engeren Sinne Orthophosphate (Monophosphate), Salze der Orthophosphorsäure H3PO4. Je nach der Anzahl der substituierten Wasserstoffatome unterscheidet man primäre P., Dihydrogenphosphate, MIH2PO4, sekundäre P., Hydrogenphosphate, MI2HPO4 und tertiäre P., neutrale P., MI3PO4. Orthophosphate haben vor allem als Düngemittel Bedeutung.
Im weiteren Sinne bezeichnet man als P. auch die Salze kondensierter Phosphorsäuren, die kondensierten P., denen Polyanionen zugrunde liegen, die durch Verknüpfung von [PO4]-Tetraedern über Sauerstoffbrücken gebildet werden. Nach der Struktur dieser Anionen werden drei Typen kondensierter P. unterschieden:
Polyphosphate, MIn+2[PnO3n+l], der allg. Struktur
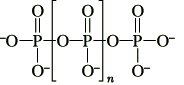
Polyphosphat-Anion
Man gewinnt sie durch Erhitzen primärer P. in meist glasiger Form. In diesen liegen stets Gemische von Salzen mit Anionen unterschiedlicher Kettenlänge vor. Polyphosphate bis zu Kettenlängen von n = 12 lassen sich chromatographisch trennen und oft als einheitliche, kristalline Verbindungen isolieren.
Metaphosphate, [MIPO3]n (n = 2 ... 8). Ihnen liegen ringförmige Polyanionen zugrunde, z. B. das Trimetaphosphat-Anion. Metaphosphate sind stets Bestandteil der durch Erhitzen primärer P. gebildeten glasartigen Phosphatgemische und lassen sich daraus abtrennen.
Man gewinnt sie in Form glasartiger Massen durch Erhitzen von Phosphatgemischen, deren Metall-Phosphor-Verhältnis kleiner als 1 ist.
Weiteres über die verschiedenen Phosphattypen Natriumphosphate, Calciumphosphate u. a.
2) Die Ester der Phosphorsäure. Phosphorsäuretriester erhält man durch Umsetzung von Alkoholen oder Phenolen mit Phosphoroxidchlorid. Wichtige Phosphorsäuretriester sind z. B. folgende: Triethylphosphat, Phosphorsäuretriethylester, (C2H5O)3PO; F. -56,4 °C, Kp. 215 bis 216 °C, nD251,4053. Es dient als Ethylierungsmittel und als Ausgangsstoff für die Herstellung insektizider Phosphorsäureester. Tributylphosphat, Phosphorsäuretributylester, (CH3-(CH2)3-O)3PO; Kp. 289 °C, nD25 1,4224. Dieses P. dient als Weichmacher für Celluloseester und als Lösungs- und Extraktionsmittel, wie auch Trioctylphosphat. Triphenylphosphat, Phosphorsäuretriphenylester, (C6H5O)3PO; F. 50 bis 51 °C, Kp. 245 °C bei 1,46 kPa. Es wird bei der Celluloidherstellung und in der Film- und Lackindustrie verwendet.
Aus der großen Palette der synthetisierten Phosphorsäureester und -thioester dienen einige als Insektizide, z. B. Parathion, und als chemische Kampfstoffe. Ihre Toxizität beruht auf der Phosphorylierung (Bildung von Phosphorsäureestern im Organismus) und Hemmung des Enzyms Acetylcholinesterase. Andererseits sind spezielle Phosphorsäureester biochemisch bedeutsame Stoffwechselzwischenprodukte, z. B. bei der alkoholischen Gärung und bei der Gluconeogenese, Bausteine von Nucleotiden (Adenosinphosphorsäuren), die Phosphatide (z. B. Lecithine und Kephaline) und die Phosphoproteide mit Phosphorsäure als prosthetischer Gruppe.

Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.