Lexikon der Chemie: Phosphor
Phosphor, Symbol P, chem. Element aus der V. Hauptgruppe des Periodensystems, der Stickstoff-Phosphor-Gruppe, Nichtmetall; Z 15, Reinelement, jedoch zahlreiche künstliche Isotope, Atommasse 30,97376, Wertigkeit III, IV und V.
Eigenschaften. P. existiert in mehreren allotropen Modifikationen: als weißer, roter und schwarzer P. Alle drei Grundtypen bilden darüber hinaus Formen unterschiedlicher Kristallstruktur und damit unterschiedlicher Dichte und Reaktivität.
Die am längsten bekannte, technisch bedeutendste, flüchtigste und reaktivste Modifikation ist der kubische, wachsartige, durchscheinend weiße P. bzw. verunreinigt gelbe P.; D. 1,82 g cm-3, F. 44,1 °C, Kp. 280 °C. In Kohlendisulfid und Phosphortrichlorid ist der üblicherweise in Stangenform gehandelte weiße P. sehr leicht löslich (100 g CS2 lösen mehr als 1000 g P.), in Benzol, Ether und Kohlenstofftetrachlorid mäßig löslich. Er hat bei Zimmertemperatur einen beträchtlichen Dampfdruck und ist mit Wasserdampf flüchtig. Bei -77 °C geht die kubische α- in eine hexagonale β-Form über. Beide Formen des weißen P. enthalten ebenso wie dessen Lösungen und der Dampf P4-Tetraeder Der sich daraus ableitende Bindungswinkel von 60° macht die hohe Reaktivität verständlich.
|
Schwarzer P., D. 2,70 g cm-3, ist die bei Zimmertemperatur thermodynamisch stabile Modifikation des Elements. Er existiert in drei kristallinen und einer amorphen Form. Orthorhombischen schwarzen P. erhält man durch Einwirkung hohen Druckes auf weißen oder roten P. oder durch druckloses Erhitzen von weißem P. in Gegenwart von Quecksilber und einem Kristallisationskeim aus schwarzem P. Er hat Halbleitereigenschaften. Das Kristallgitter besteht aus unendlichen, gewellten Doppelschichten, (Abb. 1), in denen jedes P-Atom pyramidal mit drei Nachbarn verknüpft ist (Bindungswinkel 100°).
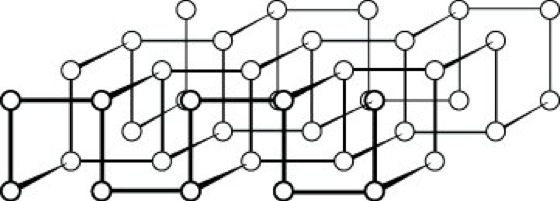
Phosphor. Abb. 1: Gitter des schwarzen Phosphors.
Der Begriff roter P. umfaßt eine Reihe unterschiedlicher kristalliner und amorpher Formen des P. Die Dichten variieren zwischen 2,0 und 2,4 g cm-3, die Schmelzpunkte zwischen 585 °C und 610 °C. Man gewinnt roten P. durch mehrstündiges Erhitzen des weißen P. auf 260 bis 400 °C. Der handelsübliche rote P. ist weitgehend amorph. Durch Rekristallisation aus geschmolzenem Blei erhält man den monoklinen Hittorfschen (violetten) P., eine polymere, dreidimensional vernetzte Form (Abb. 2).

Phosphor. Abb. 2: Struktur des violetten Phosphors.
P. ist hinsichtlich seines Bindungsverhaltens außerordentlich variabel. Man kennt Verbindungen des P. in den Koordinationszahlen 1 bis 6. Grundlage einer Bindungsdiskussion ist die Elektronenkonfiguration [Ne]3s2p3. Erwartungsgemäß eignen sich die drei ungepaarten p-Elektronen zur Knüpfung von drei Kovalenzen. Entsprechende Verbindungen wie PH3, PHal3, P(C4H9)3 oder P(OC2H5)3 weisen pyramidale Struktur auf. Der Bindungswinkel am P. ist generell kleiner als bei vergleichbaren Stickstoffderivaten (meist um 100 °, für PH3 93°). Das läßt auf weitgehenden s-Charakter des freien Elektronenpaares schließen und macht die Tatsache verständlich, daß trivalente P-Verbindungen sehr viel weniger basisch als ihre N-Analoga sind. PF5, PCl5 und PR5 sind trigonal-bipyramidal und PF6- und PCl6- oktaedrisch gebaut; PH4+- und PR4+- Ionen haben tetraedrische Struktur. Auch Verbindungen mit pπ-Doppel- und pπ-Dreifachbindungssystemen des P. sind bekannt. (z. B. Phosphorin, Ph-P=CH-NMe2, tert-Bu-C≡P). Verbreitet und sehr stabil sind Derivate des P. mit dπpπ-Doppelbindungen, z. B. (HO)3P=O, Cl3P=O, R3P=O, R3P=NR, (R = Alkyl- oder Arylrest) sowie Phosphor-Ylide (Ylide).
Bevorzugt ist die Phosphorylgruppierung -/ P=O mit einer Bindungsenergie um 540 kJ/mol, deren Bildung die Triebkraft vieler Reaktionen in der Phosphorchemie darstellt (phosphorige Säure, Michaelis-Arbusow-Reaktion, Wittig-Reaktion).
Der weiße P. ist in feinverteiltem Zustand an der Luft pyrophor. Auch kompakte Stücke entzünden sich bei 50 °C und verbrennen zu Phosphor(V)-oxid: P4 + 5 O2 → P4O10. Deshalb ist P. stets unter Wasser aufzubewahren. Unter bestimmten Bedingungen zeigt weißer P. an der Luft ein hellgrünes Leuchten, das auf eine Gasphasenoxidation von Phosphordampf über P4O6, zu P4O10 zurückgeführt wird (Chemilumineszenz). In heißen konz. Alkalilaugen disproportioniert weißer P. unter Bildung von Phosphin und Hypophosphit, z. B. P4 + 3 KOH + 3 H2O → PH3 + 3 KH2PO2. Weißer P. wirkt stark reduzierend. Beispielsweise scheidet er Silber, Kupfer und Blei aus deren wäßrigen Salzlösungen ab. Dischwefeldichlorid wird zu Schwefel, Kaliumiodat zu Iod reduziert: P4 + 6 S2Cl2 → 4 PCl3 + 12 S; P4 + 12 KIO3 → 4 K3PO4 + 6 I2 + 10 O2. Während sich P4 bei Zimmertemperatur gegenüber Wasser indifferent verhält, reagiert er oberhalb 200 °C mit Wasser zu Phosphin PH3 und phosphoriger Säure H3PO3. Oberhalb 1000 °C reduziert P. Wasser in der Dampfphase zu Wasserstoff: P4 + 10 H2O → P4O10 + 10 H2 .
Der nahezu ungiftige, in üblichen Lösungsmitteln unlösliche rote P. liegt bezüglich seiner Reaktivität zwischen der der weißen und schwarzen Modifikation. Er ist nicht pyrophor, wird von feuchter Luft nur sehr langsam unter Bildung von Orthophosphorsäure angegriffen. Konz. Salpetersäure und konz. Schwefelsäure oxidieren roten P. ebenfalls zu Orthophosphorsäure: P + 5 HNO3 → H3PO4 + 5 NO2 + H2O bzw. 4 P + 8 H2SO4 → 4 H3PO4 + S + 7 SO2 + H2O. Beim Verreiben mit starken Oxidationsmitteln wie Kaliumchlorat erfolgt heftige Explosion.
Alle P-Modifikationen bilden bei stärkerem Erhitzen einen aus P4-Molekülen bestehenden Dampf. Oberhalb 800 °C setzt zunehmende Dissoziation in P2-Einheiten ein. Bei 1700 °C besteht der Dampf zu etwa gleichen Anteilen aus P4- und P2-Molekülen.
Analytisches. P. wird mit Ammoniummolybdat nachgewiesen: H3PO4 + 12 (NH4)2MoO4 + 21 HNO3 → (NH4)3PMo12O40 + 21 NH4NO3 + 12 H2O. Diese Fällungsreaktion eignet sich auch zur quantitativen gravimetrischen Bestimmung des P. Als Methode zur Strukturuntersuchung phosphorhaltiger Verbindungen bietet sich die 31P-Kernresonanzspektroskopie an.
Vorkommen. P. ist am Aufbau der Erdkruste zu etwa 0,11 % beteiligt und kommt in der Natur in Form verschiedener Phosphate vor. Ökonomisch wichtig sind die Apatite Ca5(PO4)3(F, Cl, OH), insbesondere der Fluorapatit, und der analog zusammengesetzte, jedoch üblicherweise mit CaCO3 durchsetzte Phosphorit. Weitere phosphorhaltige Minerale sind der Wavellit Al3(PO4)2(F, OH)·5 H2O, der Vivianit Fe3(PO4)2·8 H2O und der als Schmuckstein begehrte Türkis CuAl6[(PO4)(OH)2]4·4 H2O. Gegenwärtig beträgt die Förderung an Rohphosphat weltweit etwa 100 Mill. t, wovon mehr als 90 % zu Phosphorsäuredüngemitteln verarbeitet werden.
Zahlreiche Phosphate sind von essentieller Bedeutung für die belebte Natur. Hydroxylapatit Ca5(PO4)3OH ist der Hauptbestandteil der Gerüstsubstanz der Knochen und Zähne. Darüber hinaus spielen Phosphate als Bauteile der Nucleinsäuren und als Energieträger in lebenden Systemen eine wichtige Rolle.
Gewinnung. Ausgangsmaterial zur technischen Gewinnung des weißen P. sind Apatit oder Phosphorit, die in Elektroöfen bei 1400 bis 1500 °C in Gegenwart von Siliciumdioxid mit Kohle nach folgender summarischer Gleichung reduziert werden: 2 Ca3(PO4)2 + 6 SiO2 + 10 C → 6 CaSiO3 + 10 CO + P4. Der gasförmig entweichende P. wird kondensiert und unter Wasser gesammelt und ausgetragen.
Verwendung. Mehr als 80 % des produzierten weißen P. werden zu Phosphor(V)-oxid verbrannt und dieses in Phosphorsäure und verschiedene Phosphate umgewandelt. Der Rest wird vorrangig zu Phosphortrichlorid PCl3 und Phosphor(V)-sulfid P4S10 verarbeitet, die ihrerseits die Basis für eine Vielzahl von Pflanzenschutzmitteln, Weichmachern, Extraktionsmitteln, Flammschutzmitteln, Schmieröl-Additiven u. a. sind. Roter P. wird zur Herstellung von Zündhölzern verwendet.
Ökologie. Die intensive Nutzung von Polyphosphaten als Enthärter in Waschmitteln hat zusammen mit den aus menschlichen und tierischen Exkrementen stammenden Anteilen die PO43--Konzentration zahlreicher Flüsse und Seen ansteigen lassen (Eutrophierung). Dies ist die Ursache eines verstärkten Algenwachstums, das das Eindringen des Sonnenlichts in tiefere Wasserschichten verhindert und so Assimilationsvorgänge und damit den Sauerstoffhaushalt empfindlich stört. Im Ergebnis dominieren Fäulnisprozesse. Die Sanierung der belasteten Gewässer erfordert eine drastische Reduzierung des Phosphatgehaltes, die durch gezielte Abwasserbehandlung, z. B. durch Fällung des Phosphats mit Eisen(III)- oder Aluminiumsalzen, zu erreichen ist. Heute werden den Waschmitteln allerdings meist Na-Al-Silicate anstelle von Phophaten zugesetzt.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.