Lexikon der Chemie: Steroide
Steroide, Verbindungen, die sich von dem tetracyclischen Kohlenwasserstoff Perhydro-1H-cyclopenta[a]-phenanthren (Trivialname bei unbekannter Stereochemie Steran, bei trans-Stellung der Ringe B/C und C/D Gonan) ableiten. Wichtige Gruppen natürlich vorkommender S. sind die Sterine, Gallensäuren, Steroidhormone und Cardenolide (herzwirksame Glycoside) sowie verschiedene N-haltige S. (Steroidalkaloide). Zu den S. gehören ferner zahlreiche Sapogenine (Saponine).
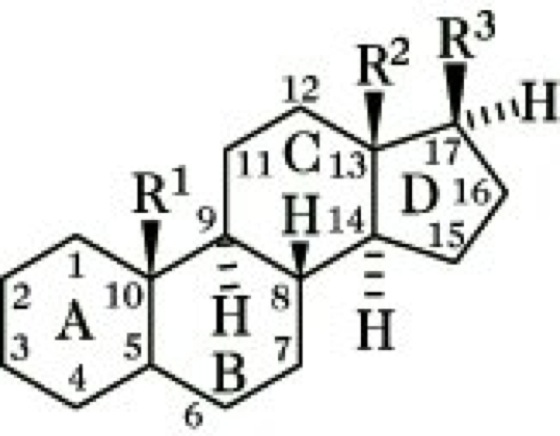

Struktur, Nomenklatur. Die Ringe der A/B, B/C und C/D können cis oder trans miteinander verbunden sein. Bei den natürlich vorkommenden S. sind die Ringe B/C immer trans verknüpft. Die meisten S. leiten sich vom Gonan ab. Bei den Cardenoliden und Bufadienoliden sind die Ringe C/D cis verknüpft. Zahlreiche S. enthalten jedoch Doppelbindungen in den Ringen A oder B und sind daher mehr oder weniger stark eingeebnet. Als Bezugspunkt für stereochem. Angaben dient die CH3-Gruppe in 13-Stellung, die immer oberhalb der Ringebene, also β-ständig, angeordnet ist. Nach der Orientierung des H-Atoms in 5-Stellung (α- oder β-ständig) wird zwischen der 5α- und 5β-Reihe unterschieden. Bei der 5α-Reihe sind die Ringe A/B trans, bei der 5β-Reihe cis verknüpft. Die meisten natürlich vorkommenden S. haben CH3-Gruppen in 13- (z. B. Estran) bzw. 10- und 13-Stellung (z. B. Androstan), sowie eine Sauerstoffunktion (Hydroxy-, Oxogruppe) in 3-Stellung. Sie enthalten meist einen Alkylrest in 17-Stellung. Ringkontraktionen werden unter Angabe des Ringes (A, B, C, D) durch das Präfix nor-, Ringerweiterungen durch homo- gekennzeichnet, z. B. A-nor, D-homo-, Ringöffnungen werden durch das Präfix seco- unter Angabe der C-Atome bezeichnet, zwischen denen die Öffnung erfolgt ist, z. B. 9,10-seco- bei den Calciferolen.
Biosynthese. Sie erfolgt ausgehend von Squalen über Squalenoxid und bei den Säugetieren über Lanosterin zum Cholesterin. Tiere und Pilze bilden als erstes stabiles cyclisches Produkt der Sterinbiosynthese das Lanosterin, Algen und höhere Pflanzen das Cycloartenol. Lanosterol und Cycloartenol werden wegen der drei zusätzlichen Methylgruppen (in 4,4- und 14-Stellung) als Methylsterine bezeichnet und zu den Triterpenen gezählt.
Vorkommen. S. kommen in Tieren, Pflanzen und Mikroorganismen, insbesondere Pilzen, vor. In Pilzen sind die Sterine und Steroidcarbonsäuren der Ergostan- und Stigmastanreihe sowie Methylsterine enthalten. Verbreitetstes Sterin ist das Ergosterin. Die S. der Tiere werden aus Cholesterin gebildet. Aus dem Chiolesterin entstehen in den Säugetieren bei weitestgehendem Abbau der Seitenkette am C17-Atom die Steroidhormone (Pregnan-, Androstan- und Estranreihe). Bei den Wirbellosen wirken die Ecdysteroide als Häutungshormone. Abbauprodukte des Cholesterins sind die Gallensäuren, bei denen es sich um Steroidcarbonsäuren handelt. Die Struktur der pflanzlichen S. ist durch Vergrößerung der Alkylkette am C17-Atom (Stigmastanreihe), durch Bildung zusätzlicher O- und N-haltiger Ringe (Saponine, Steroidalkaloide) oder durch das Vorhandensein eines ungesättigten Lactonringes (Cardenolide, Bufadienolide) wesentlich vielfältiger. Pflanzliche S. liegen meist als Glycoside vor, wobei der Zuckerrest vorwiegend an der 3β-Hydroxygruppe gebunden ist. In Erdöl wurden Steroidcarbonsäuren gefunden.
Synthesen. Steroidsynthesen haben für die Bereitstellung von Arzneimitteln, insbesondere Hormonen, für Mensch und Tier große ökonomische Bedeutung. Es werden Partial- und Totalsynthesen durchgeführt. Partialsynthesen gehen von möglichst billigen S. aus, vor allem von Diosgenin, Cholesterin, Stigmasterin, Gallensäuren und Steroidalkaloiden. Die Umwandlung zum gewünschten S. kann mikrobiologisch (mikrobielle Steroidtransformation) oder chemisch erfolgen. Mikrobiologische Umwandlungen werden dann eingesetzt, wenn entsprechende chem. Methoden nicht oder nur sehr aufwendig bzw. in zu geringer Ausbeute erfolgen können und hohe Anforderungen an die Selektivität gestellt werden. Chem. Methoden der Partialsynthese sind vor allem Oxidationen, Dehydrierungen, Halogenierungen, Methylierungen, Anellierungen (Robinson-Anellierung) oder Ethinylierungen. Totalsynthesen sind in den letzten Jahren durch die gestiegenen Preise der als Ausgangsprodukte für die Partialsynthese benötigten Rohstoffe und die Fortschritte bei der Entwicklung stereoselektiver Synthesen auch ökonomisch bedeutsam geworden. Das gilt vor allem für die Synthese von Östrogenen und 19-nor-S.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.