Lexikon der Biochemie: Alkaloide
Alkaloide, basische Naturstoffe, die in erster Linie in Pflanzen vorkommen. Sie enthalten ein oder mehrere Stickstoffatome und kommen im Allgemeinen als Salze organischer Säuren vor. Es sind mehrere tausend A. bekannt. Sie tragen gewöhnlich Trivialnamen, die sich von der Pflanze ableiten, in der sie vorkommen.
Einteilung. Eine Abgrenzung der A. gegenüber anderen stickstoffhaltigen Pflanzenstoffen ist schwierig. Bei der Einteilung nach Vorkommen und Funktion würden einerseits die A. tierischen oder mikrobiellen Ursprungs ausgeschlossen und andererseits die in entfernten Pflanzenfamilien vorkommenden A. (z.B. das weitverbreitete Nicotin) eine strenge Einordnung nach botanisch-systematischen Gesichtspunkten behindern.
Bei einer Einordnung der A. entsprechend der chemischen Struktur ihrer heterozyklischen Grundgerüste finden die Colchicumalkaloide keine Berücksichtigung, weil ihnen der heterozyklische Stickstoff fehlt.
In neuerer Zeit wurden biogenetische Aspekte zur Abgrenzung bzw. Einteilung der A. herangezogen und zwischen Protoalkaloiden (biogene Amine), Pseudoalkaloiden und den A. im engeren Sinn unterschieden. Zu den Protoalkaloiden zählen z.B. die biogenen AminePutrescin, Spermidin und Spermin (Polyamine), zu den Pseudoalkaloiden jene A., die strukturell anderen Naturstoffen (z.B. den Terpenen, etwa Actinidin) nahestehen. Die A. im engeren Sinn lassen sich nach ihren biogenetischen Vorstufen weiter unterteilen in Abkömmlinge der Ornithin-, Lysin-, Phenylalanin-, Tryptophan- und Anthranilsäure. Bei der in der Tabelle vorgenommenen Einteilung werden strukturchemische und biogenetische Gesichtspunkte berücksichtigt.
Vorkommen. Wahrscheinlich enthalten etwa 10-20 % aller höheren Pflanzen A.; allerdings treten sie in einigen Familien der Dikotyledonen gehäuft auf. Systematisch einander nahestehende Pflanzenfamilien führen oftmals ähnliche A. Im Allgemeinen enthält eine Pflanze Gemische strukturähnlicher A. (Haupt- und Nebenalkaloide, bzw. primäre und sekundäre A.), die in Form ihrer hydrophilen Salze im Zellsaft der Vakuole gelöst sind. Die A. kommen in allen Teilen der Pflanze vor, treten aber in gewissen Organen (Samen, Rinde, Wurzel) gehäuft auf. Außerhalb der höheren Pflanzen finden sich den A. strukturell ähnliche heterozyklische Verbindungen in vielen Mikroorganismen und vereinzelt in Tieren (z.B. Salamanderalkaloide).
Biosynthese. A. sind Endprodukte des Sekundärstoffwechsels, die keinem nennenswerten Abbau unterliegen (Tab.). Sie häufen sich an, weil der Pflanze Ausscheidungsorgane fehlen. Die meisten A. sind Derivate von Aminosäuren, besonders von Ornithin, Lysin, Phenylalanin oder Tyrosin, Tryptophan und Anthranilsäure, die auch den heterozyklischen Stickstoff liefern. Daneben können außerdem Essigsäure, Mevalonsäure und C1-Bausteine am Aufbau der A. beteiligt sein. Auf den Zusammenhang zwischen Alkaloidbildung und Aminosäurestoffwechsel wurde bereits um die Jahrhundertwende hingewiesen. Bahnbrechend waren schließlich die Versuche zur Darstellung von A. unter physiologischen Bedingungen, d.h. mit nativen Reaktionspartnern, ohne Einwirkung von Druck und erhöhter Temperatur bei neutralem pH-Wert zu synthetisieren. Durch Verabreichung von 13C-, 14C-, 15N- oder 3H-markierten Aminosäuren ließ sich die Biosynthese der A. in vivo verfolgen. Dabei zeigte sich, dass die Pflanze den sehr großen Formenreichtum der heterozyklischen Verbindungen nicht nur aus wenigen Bausteinen, sondern auch mit einer geringen Anzahl immer wiederkehrender Zyklisierungsmechanismen aufbaut: N-heterozyklische Ringe entstehen durch Mannich-Kondensation, oder durch die Bildung von Amiden oder Schiffscher Basen. Sekundäre Zyklisierungen, d.h. Ringschlüsse ohne Beteiligung von Stickstoff, sind eine Folge oxidativer Kupplungen (Phenoloxidation).
Synthese. 1886 gelang Ladenburg durch den Aufbau des Coniins aus α-Picolin die erste Synthese eines Alkaloids. Ausgehend von der Hypothese, dass A. in der Pflanze aus Aminosäurederivaten entstehen, wurden von Robinson und Schöpf entsprechende Synthesewege entwickelt und unter physiologischen Bedingungen geprüft (Tropinon). Diese Untersuchungen gaben die Anregung für chemische Laborsynthesen und einige Verbindungen wurden zum ersten Mal entsprechend den in Pflanzen vorkommenden Wegen synthetisiert. Die meisten A. für die medizinische Verwendung werden aus pflanzlichen Quellen hergestellt.
Biologische und wirtschaftliche Bedeutung. Eine allgemein gültige Erklärung für die biologische Bedeutung der A. kann noch nicht gegeben werden. Offensichtlich erfüllen A. eine ökochemische Funktion, indem sie die Pflanze einerseits vor Fressfeinden (Mensch und Tier) und andererseits vor Krankheitserregern (Viren, Bakterien, Pilze) schützen. Auch die Tatsache, dass sich die meisten Insekten auf eine oder wenige Nahrungspflanzen beschränken, ist auf den Alkaloidgehalt der jeweiligen Spezies zurückzuführen. Einige Schmetterlingsraupen reichern z.B. die A., die sie durch das Fressen alkaloidhaltiger Pflanzen aufnehmen, an und schützen sich dadurch vor Fressfeinden. Viele A. zeichnen sich durch eine starke, meist sehr spezifische Wirkung auf bestimmte Zentren des Nervensystems aus (z.B. Opiate, Endorphine). Deshalb werden Reinalkaloide, Kombinationspräparate, Gesamtalkaloidextrakte oder synthetische Analoga in großem Umfang therapeutisch als Heil-, Anregungs- und Betäubungsmittel angewandt. Ihr Gebrauch ist aber nicht frei von unerwünschten Nebenwirkungen, deren Ursachen vorwiegend in der Toxizität der A. und ihrer Eigenschaft als Rauschmittel zu suchen sind.
Geschichtliches. Wegen ihrer Giftigkeit oder nutzbaren pharmakologischen Eigenschaften waren die meisten Alkaloidpflanzen schon frühzeitig in der Volksmedizin bekannt. Morphin wurde zuerst 1806 von F.W. Sertürner als "schlafmachendes Prinzip" des Mohns isoliert. Den Begriff A. prägte 1819 C.F.W. Meißner.
Weitere Informationen zu A.: Amaryllidazeen-Alkaloide, Isochinolin-Alkaloide.
Alkaloide. Tab. Die wichtigsten Alkaloidgruppen und ihre Vorstufen.
| |||
| Pyrrolidin-alkaloide | 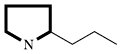 | Ornithin, Acetat | |
| Pyrrolizidin-alkaloide | 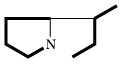 | Ornithin | |
| Tropanalkaloide | 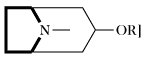 | Ornithin, Acetat | |
| Piperidinalkaloide (Conium) | 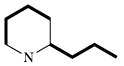 | Acetat | |
| Piperidinalkaloide (Punica, Sedum, Lobelia) | 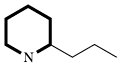 | Lysin, Acetat oder Phenylalanin | |
| Chinolizidin-alkaloide | 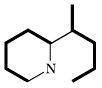 | Lysin | |
| Isochinolin-alkaloide | 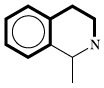 | Phenylalanin oder Tyrosin | |
| Indolalkaloide | 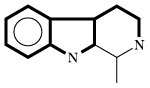 | Tryptophan | |
| Chinolin (Rutaceae) | 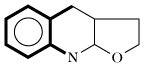 | Anthranilsäure | |
| Terpenalkaloide | 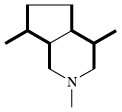 | Mevalonsäure |
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.