Lexikon der Biochemie: Auxine
Auxine, eine Gruppe von Pflanzenhormonen, die zu den wichtigsten Regulatoren des Pflanzenwachstums zählt. Natürliche A. sind Indolderivate, von denen man bisher annahm, dass ihre Biosynthese von L-Tryptophan ausgeht. Es könnte aber nötig werden, diese Ansicht zu ändern, da ein tryptophanunabhängiger Weg zur Synthese des wichtigsten Auxins, der Indolyl-3-essigsäure (IES, engl. indol-3-acetic acid, IAA, Abb.) entdeckt wurde. In Maisund Arabidopsis wird Indolyl-3-acetonitril mit Hilfe einer Nitrilase in Indolyl-3-Essigsäure umgewandelt [J. Normanly et al. Pro.c Natl. Acad. Sci. USA90 (1993) 10.355-10.359]. Die Indolyl-3-essigsäure (Heteroauxin; Abb.) wird als Standard für den Aktivitätsvergleich mit anderen Wachstumsstimulanzien verwendet. IES wird durch höhere Pflanzen synthetisiert (z.B. enthalten Ananaspflanzen 6mg/kg Frischgewicht). Sie wurde ebenso in vielen niederen Pflanzen gefunden und kommt auch als Stoffwechselprodukt in Bakterien vor. Der früher zur quantitativen Auxinbestimmung meistens verwendete Hafercoleoptilen-Krümmungstest wurde durch empfindlichere physikalische Methoden, wie Hochleistungsflüssigkeitschromatographie (HPLC) oder Gaschromatographie (GC), kombiniert mit Massenspektrometrie, ersetzt. Andere natürliche A. sind: 2-(-Indolyl)ethanol (Tryptophol); 2-(3-Indolyl)acetaldehyd; 2-(3-Indolyl)acetonitril; 2-(3-Indolyl)acetamid; 3-(3-Indolyl)propionsäure; 4-(3-Indolyl)butansäure; 3-(3-Indolyl)bernsteinsäure; 2-(3-Indolyl)glycolsäure; 2-(3-Indolyl)acetyl-β-D-glucose; [2-(3-Indolyl)acetyl]aspartatsäure; 2-(3-Indolyl)acetyl-meso-inositol; 2-(3-Indolyl)acetyl-meso-inositol-galactosid; 2-(3-Indolyl)acetyl-meso-inositol-arabinosid. Verbindungen, die einen Zucker- oder Aminosäurerest enthalten, die sog. Auxinkonjugate, stellen vermutlich Speicher- und Transportformen dar.
Die A. regulieren die Wurzel- und Sprossbildung, indem sie das Streckungswachstum und die Zellteilung im Kambium stimulieren. Eine Acidifizierung der Zellwand als Reaktion auf A. (vermutlich aufgrund der Stimulation von H+-ATPase der Plasmamembran) ist zumindest zum Teil für den Verlust von Zellwänden und die Stimulation des Streckungswachstums verantwortlich. A. verursachen auch eine Membranhyperpolarisation.
Der Auxin-Signalweg innerhalb der Pflanzenzelle ist unklar, aber vermutlich ist ein G-Protein beteiligt. Das Auxinsignal wird nach der Bindung an die Plasmamembran durch das auxinbindende Protein übermittelt. Die Bindung von Auxin an das auxinbindende Protein ZmABP1 wurde durch Photoaffinitätsmarkierung des reifen Proteins (163 Aminosäurereste), unter Verwendung des Auxinhomologen 5-[7-H-3]Azidoindol-3-essigsäure untersucht. Die Analyse der tryptischen Fragmente des markierten Proteins zeigte, dass Asp134 der markierte Rest ist, während Trp136 vermutlich auch zur hydrophoben Bindung des aromatischen Auxinrings beiträgt.
Als Reaktion auf Auxin werden bestimmte Gene schnell transcribiert. Dies trifft insbesondere auf die SAUR-Gene (engl. small auxin-up-regulated RNA-genes, sinngemäß: durch-Auxin-aktivierte-RNA-Gene) zu, deren Funktion unbekannt ist. Der Promotor für das SAUR15A-Gen der Sojabohne enthält zwei benachbarte, auf Auxin reagierende Sequenzen, TGTCTC und GGTCCCAT [Y. Li et al. Plant Physiol. 106 (1994) 37-43]. Andere durch Auxin induzierbare Gene enthalten die auf Auxin reagierenden Elemente entweder innerhalb des Leserasters oder innerhalb nichttranscribierter Regionen, wie dem Promotor. Wahrscheinlich sind einige Proteine, deren Gene auf Auxin reagierende Elemente enthalten, Aktivatoren oder Repressoren von Genen, die Auxinreaktionen vermitteln, z.B. die Proteine PSIAA6 und PSIAA4 der Erbse. Beide Proteine werden nach Auxininduktion extrem schnell transcribiert, beide zeigen sehr hohe Wechselzahlen (Halbwertszeit 8 bzw. 6min), beide tragen vermutlich Erkennungssignale für die Zellkernlokalisierung und ein βαα-DNA-bindendes Strukturmotiv, ähnlich denen der Arc-Familie der prokaryontischen Repressoren [S. Abel et al. Proc. Natl. Acad. Sci. USA91 (1994) 326-330]. Weiterhin wurden proteinbindende Regionen in der Promotorregion des auf Auxin reagierenden Gens der Sojabohne, GmAux28, identifiziert (unter Verwendung von DNAase I und Gelmobilitätsverschiebungsanalysen) [R.T. Nagao Plant Mol. Biol.21 (1993) 1.147-1.162].
[K. Palme J. Plant Growth Reg. 12 (1993) 171-178; S. Brunn et al. ACS Symp. Series557 (1994) 202-211; M. Blatt u. G.Thiel Annu. Rev. Plant Physiol. Plant Mol. Biol. 44 (1993) 543-567; L. Hobbie u. M. Estelle Plant Cell Envir. 17 (1994) 525-540; Y.Takahashi et al. Plant Res. 106 (1993) 367; C. Garbers u. C. Simmons Trends in Cell Biology4 (1994) 245-250; P.A. Millner Current Opinion in Cell Biology7 (1995) 224-231]
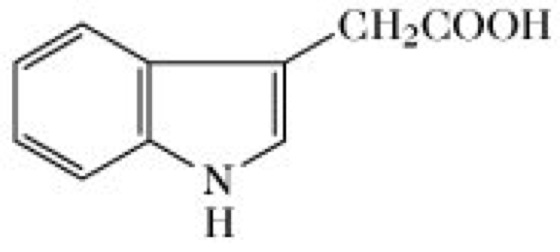
Auxine. 2-(3-Indolyl)essigsäure.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.