Lexikon der Biochemie: Blutgerinnung
Blutgerinnung, ein Prozess, in dem das Blut ein Blutgerinnsel bildet, das dicht genug ist, um das Bluten aus einer Wunde zu verhindern. Bei den meisten Wirbellosen besteht dieser Prozess darin, einen Pfropfen agglutinierter Blutzellen zu bilden. Wirbeltiere und einige Krebse bilden das Blutgerinnsel sowohl aus Fibrin als auch aus abgefangenen Blutzellen. Das Fibrin bildet ein vernetztes, unlösliches Polymer. Es entsteht aus seiner Vorstufe Fibrinogen (einem großen, aber löslichen Plasmaprotein) mit Hilfe der hochspezifischen Serinprotease Thrombin und des Faktors XIIIa. Der Faktor XIIIa katalysiert die Transamidierung zwischen Glutamin- und Lysinresten, wodurch Bindungen zwischen benachbarten Polypeptidketten im ausgefällten Fibrin gebildet werden.
Die Freisetzung von Thrombin aus seinem inaktiven Proenzym Prothrombin ist der vorletzte Schritt in einer Reihe von Reaktionen, von denen jede eine aktive Serinprotease aus einer inaktiven Vorstufe im Blut freisetzt (Abb.). Dies ist ein Beispiel für eine kaskadenartige Regulation, bei der jede aktivierte Protease die nächste in der Reihe darunterliegende Vorstufe aktiviert, wodurch bei jedem Schritt die beteiligten Materialmengen vermehrt werden (d.h. es findet eine Verstärkung statt). Die Gerinnungsfaktoren sind in der Tabelle aufgeführt. Die römischen Ziffern werden aus historischen Gründen verwendet und aktivierte Formen erhalten das Subskript "a" (z.B. XIIa).
Traditionell unterscheidet man zwischen intrinsischem und extrinsichem Blutgerinnungssystem. So gerinnt das Blutplasma auch, allerdings relativ langsam (in wenigen Minuten), in Gegenwart einer fremden Oberfläche, wie Kaolin oder Glas. – Aus diesem Grund wird Blut für klinische Zwecke in Gefäße abgenommen, die mit Heparin oder Ca2+-bindenden Agenzien wie Citrat oder EDTA beschichtet sind. – Die beteiligten Faktoren sind alle im Plasma enthalten (intrinsisch). Die physiologische Bedeutung der Aktivierung des intrinsischen Systems durch fremde Oberflächen ist nicht bekannt. Beteiligt sind die Proteine XII, XI, hochmolekulares Kininogen und Präkallikrein.
Das extrinsische System, das durch spezifische proteinhaltige Gewebefaktoren und Phospholipide aktiviert wird, produziert innerhalb von Sekunden ein Blutgerinnsel. Der Faktor VII ist der einzige Plasmafaktor, der nur dem extrinsischen System angehört. Er kann jedoch durch den Faktor XIIa oder Kallikrein aktiviert werden, die beide Mitglieder des intrinsischen Systems sind. Außerdem stimulieren niedrige Konzentrationen an Prostacyclin oder Prostaglandin E1 (zu niedrig, um den cAMP-Spiegel anzuheben) die Cystein-Protease gereinigter Blutplättchen, wodurch der Faktor X aktiviert wird. Dies legt die Vermutung nahe, dass die Unterscheidung zwischen intrinsischen und extrinsischem System möglicherweise künstlich ist [A.K. Dutta-Roy et al. Science 231 (1986) 385-388].
Unter physiologischen Bedingungen erfolgt die Umwandlung von Prothrombin in Thrombin durch den Faktor X anscheinend nur, wenn eine Bindung an eine Zellmembran vorliegt. Den Rezeptor für den Faktor X bildet der Faktor V der Blutplättchenzellmembran, welcher die proteolytische Aktivität von X erhöht.
Das Ausmaß der B. wird in vivo durch Aktivierung des Vitamin K-abhängigen Proteins K begrenzt. Dieses ist eine Serinprotease, die aus zwei, durch Disulfidbrücke(n) verbundene Polypeptidketten (Mr 21kDa und 35kDa) besteht. Sie weist in hohem Maß Sequenzhomologie zum Gla-enthaltenden Gerinnungsfaktor (Gla, 4-Carboxyglutaminsäure) auf und ist wie dieser als Proenzym im Plasma vorhanden. Aktiviertes Protein C inaktiviert die Faktoren Va und VIIIa durch limitierte Proteolyse. Da Va und VIIIa für die effiziente Umwandlung von X in Xa benötigt werden, dient das Protein C, das identisch mit dem Autoprothrombin IIA ist, als negatives Rückkopplungs-Regulationselement der B. [T. Drakenberg et al. Proc. Natl. Acad. Sci. USA80 (1983) 1.902-1.906; L.M. Jackson u. Y. Nemerson Ann. Rev. Biochem.49 (1980) 765-811; L. Lorand Methods Enzymol45B (1976) 31-37]
Die Blutgerinnungsfaktoren wurden durch die Analyse von Hämophilien entdeckt, von denen die bekannteste Form durch das Fehlen des Faktors VIII verursacht wird. Die anderen Faktoren wurden durch Komplementierung von nicht gerinnenden Plasmamischungen gefunden. Präkallikrein, Prothrombin und die Faktoren XII, XI, X, IX und VII werden durch die Spaltung spezifischer Peptidbindungen in Serin-Proteasen überführt. Prothrombin und die Faktoren VII, IX, X und XI weisen homologe N-terminale Regionen auf, die multiple Gla-Reste enthalten. Diese Reste sind für die Bindung von Ca2+ und die Ca2+-vermittelte Bindung der Proteine an Phospholipide (z.B. Blutplättchenmembranen) essenziell. [C.T. Esmon "Cell Mediated Events that Control Blood Coagulation and Vacular Injury" Annu. Rev. Cell Biol. 9 (1993) 1-26]
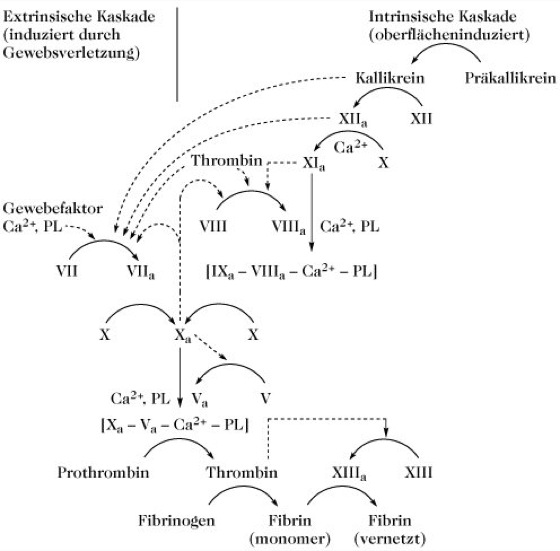
Blutgerinnung.Abb. Die Blutgerinnungskaskade. PL = Phospholipid oder Zellmembran. Durchgezogene Pfeile zeigen Reaktionen an, gestrichelte Pfeile katalytische Einwirkung. (nach: L. Lorand Methods Enzymol. 45B (1976) 31-37.)
Blutgerinnung.Tab. Faktoren der Blutgerinnungskaskade.
| |||
| I | Fibrinogen | Mr 340 kDa, besteht aus 6 Ketten: (Aα)2(Bβ)2γ2. Die Umwandlung in Fibrin erfolgt durch Abspaltung von 2 A- oder 2 B-Peptiden. Fibrin wird durch Plasmin gelöst, eine Protease, die mit den Gerinnungsfaktoren verwandt ist und durch ihre eigene Aktivitätskaskade aus Plasminogen freigesetzt wird. | |
| II | Prothromhin IIa ist Thrombin | Mr 72kDa, 582 Aminosäuren mit 12 Disulfidbrücken und 10 Gla*-Resten; ein Glycoprotein. Die Umwandlung in Thrombin erfolgt mit Hilfe von X; Thrombin wird durch Antithrombin III, α2-Makroglobulin, α1-Antitrypsin und Hirudin inhibiert. | |
| III | Gewebefaktor | Ein spezifisches Protein + Phospholipide. | |
| IV | Calciumionen | Vermitteln die Bindung von IX, X und VII und von Prothrombin an saure Phospholipide der Zellmembranen, dem Ort ihrer Aktivierung. Sie stabilisieren V, Fibrinogen und möglicherweise Proteine, die an der Aktivierung und Untereinheitendissoziation von XIII beteiligt sind. | |
| V | Proaccelerin Va ist Accelerin | Labiles Glycoprotein, Mr 350 kDa. Va vermittelt die Bindung von X und Prothrombin an die Blutplättchen, wo X aktiviert und Prothrombin in Thrombin umgewandelt wird. | |
| Vll | Proconvertin | Mr 45-54kDa. Enthält Gla*. Es ist Teil der extrinsischen Kaskade. VII wird bei Gewebsverletzung freigesetzt. | |
| Vlll | antihämophiler Faktor | Verschiedene Formen, Mr 10-100 kDa. Es ist unbekannt, welche der Formen bei der Gerinnung aktiv ist. Fungiert als akzessorischer Faktor bei der Aktivierung von X durch IXa. Ein Mangel an VIII ist die Ursache der klassischen Bluterkrankheit (Hämophilie A). | |
| IX | Christmas-Faktor | Mr 55,4kDa (Rind), 57kDa (Mensch), einkettiges Glycoprotein. IXa enthält schwere Ketten, die Homologien zu Serinproteasen aufweisen, und eine leichte Kette mit Gla*. Ein Mangel ist die Ursache der angeborenen Bluterkrankheit (Hämophilie B) | |
| X | Stuart-Faktor | Mr 54,4kDa (Rind), 59kDa (Mensch). 12 Gla*-Reste vorhanden. Aktivierung erfolgt durch 1) IXa + VIIIa + Ca2+ oder 2) VIIa + Gewebsfaktor + Ca2+ oder 3) durch die Blutplättchenmembran-Protease. | |
| XI | Plasmathrombo-plastin, Antecedent (PTA) | Mr 124kDa (Rind), 160 kDa (Mensch). Glycoprotein, das aus zwei ähnlichen oder gleichen Polypeptiden besteht, verbunden durch Disulfidbrücke(n). Es aktiviert X. XIa wird inhibiert durch Antithrombin III, Trypsininhibitoren, α1-Trypsininhibitor und C1-Inhibitor. | |
| XII | Hageman-Faktor | Der erste Faktor des intrinsischen Systems. Mr 74kDa (Rind), 76kDa (Mensch); Einkettenglycoprotein. Aktivierung erfolgt durch Plasmin, Kallikrein und XIIa. Inhibierung erfolgt durch Antithrombin III (beschleunigt durch Heparin), C1-Esteraseinhibitor und Limabohnentrypsininhibitor. Aktivierung von XII wird durch Kontakt mit anormalen Oberflächen initiiert. | |
| XIII | Fibrinstabilisierender Faktor (Laki-Lorand-Faktor) | Mr 320 kDa (tetramere Plasmaform), Mr 160 kDa (dimere Blutplättchenform). Beide Formen enthalten zwei a-Untereinheiten, die bei Aktivierung gespalten werden. Die Plasmaform enthält noch zwei b-Untereinheiten. XIIIa ist die für die Quervernetzung von Fibrinfibrillen verantwortliche Transpeptidase. | |
| Präkallikrein | Aktivierung ergibt Kallikrein, eine Serinprotease, die XII aktiviert. | ||
| HMW (high molecular weight)-Kininogen, Kontaktaktivierungs-faktor, Fitzgerald-Faktor, Flaujeac-Faktor | Aktivierung ergibt Kinin, das – zumindest in vitro – an der Aktivierung von XII beteiligt ist. |
*Gla = 4-Carboxyglutaminsäure
a = aktivierte Form
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.