Lexikon der Biochemie: Chymotrypsin
Chymotrypsin, eine Familie strukturell und katalytisch homologer Serinproteasen (Proteasen), des Pankreas, in dem sie als Zymogene gebildet und gespeichert werden. Chymotrypsinogen A (pI 9,1, 245 Aminosäuren, Mr 25,67kDa) ist bei pH 8 kationisch, während Chymotrypsinogen B (pI 5,2, 248 Aminosäuren, Mr 25,76kDa) bei pH 8 anionisch ist. Aus der Schweinebauchspeicheldrüse, der das Chymotrypsinogen B fehlt, wurde Chymotrypsinogen C (Mr 31,8kDa, 281 Aminosäuren, Trp-reich) isoliert. Die aktivierten Formen besitzen unterschiedliche Substratspezifitäten. Alle Chymotrypsinogene hydrolysieren bevorzugt Tyrosyl- und Tryptophanylpeptidbindungen und -esterbindungen mit einem pH-Optimum bei 8-8,5. Chymotrypsinogen B greift auch andere Bindungen an (z.B. im Glucagon) und Chymotrypsinogen hydrolysiert zusätzlich Leucyl- und Glutaminylbindungen.
Das Chymotrypsinogen A besteht aus einer Polypeptidkette mit fünf intrachenaren Disulfidbrücken ( 1-122, 42-58, 136-201, 168-182, 191-221). Durch Trypsinaktivierung wird die Peptidbindung zwischen Arg15-Ile16 gespalten, wodurch das aktive π-C. entsteht. In einem Autolyseprozess spaltet das π-C. aus anderen π-Chymotrypsinmolekülen die Dipeptide Ser14-Arg15 und Thr147-Asn148 heraus. Es entsteht eine Dreikettenstruktur mit gleicher Aktivität, das α-C. Die katalytisch aktiven Aminosäuren His57, Asp102 und Ser195 sind auf den B- und C-Ketten lokalisiert (Abb. 1).
Die Tertiärstruktur des α-C. besteht meistens aus gestreckten Kettensegmenten, die durch Wasserstoffbrückenbindungen und fünf Disulfidbrücken miteinander verbunden sind. Mit Ausnahme der 11 Aminosäuren am Carboxylende der C-Kette enthält das Molekül keine α-Helices. Das aktive Zentrum befindet sich wie beim Trypsin in einer locker strukturierten Region des Moleküls mit einer taschenförmigen Einstülpung zur Aufnahme der Aminosäure des Substrats (Abb. 2). Die "Tasche" bestimmt die Substratspezifität des Enzyms. Der Ser189-Rest ist tief in ihr angeordnet.
Im Verlauf der Aktivierung rotiert das Kettensegment 187-194 um 180 ° und bringt die katalytischen Aminosäuren bis auf 0,3nm an die Oberfläche des Moleküls. Die Substrathydrolyse erfolgt über ein Enzym-Acyl-Intermediat, das einen Ester zwischen der nucleophilen Hydroxylgruppe des Ser195 und der Säuregruppe der zu spaltenden Peptidbindung darstellt. Der stark nucleophile Charakter des Ser195 rührt vom benachbarten Protonendonor bzw. -akzeptor His57 her. Der Effekt wird durch Asp102 verstärkt (Protonenrelais).
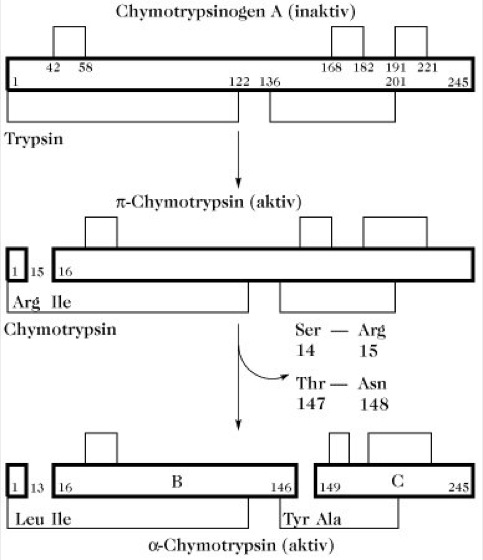
Chymotrypsin.Abb. 1. Aktivierung des Chymotrypsinogens.
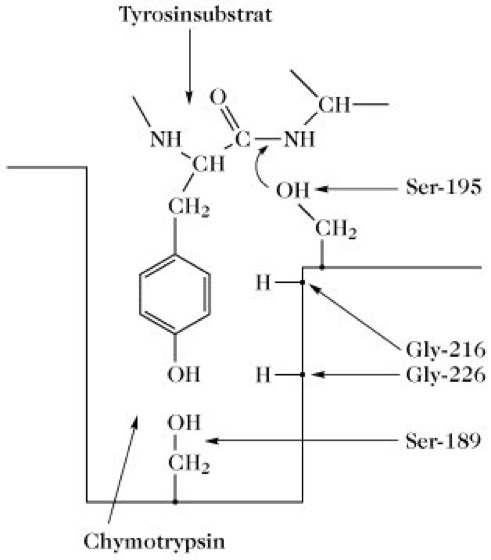
Chymotrypsin. Abb. 2. Die Substratbindungsstelle des Chymotrypsins.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.