Lexikon der Biochemie: Cytochrome
Cytochrome, Hämproteine, die als partikelgebundene Redoxkatalysatoren bei der Zellatmung, Energiekonservierung, Photosynthese und einigen anaeroben bakteriellen Vorgängen fungieren. Sie dienen sowohl als Elektronendonatoren wie auch als -akzeptoren, weil das zentrale Eisenatom des Porphyrinkomplexes einen reversiblen Valenzwechsel ermöglicht:
Fe3+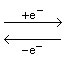
Fe2+.
C. sind lebenswichtiger Bestandteil aller Organismen. Sie gehören zu den ältesten Proteinen, deren Struktur sich in den letzten zwei Milliarden Jahren durch Punktmutationen nur unwesentlich geändert hat. Nach ihrer Struktur und ihren Spektren, insbesondere der α-, β- und γ-Bande, unterscheidet man drei Hauptgruppen, C. a, b und c, mit annähernd 30 Vertretern, die durch Hinzufügen von Indizes gekennzeichnet werden, z.B. Cytochrom b1. Alle drei Typen kommen in den Mitochondrien höherer Pflanzen und Tiere vor, wo sie einen wesentlichen Bestandteil der Atmungskette bilden.
C. a und C. a3 sind die Oxidations-Reduktions-Einheiten der Cytochrom-Oxidase.
Cytochrom b enthält wie Hämoglobin das Eisen(II)-protoporphyrin IX als prosthetische Gruppe. Es besitzt das niedrigste Redoxpotenzial der Atmungskette und liegt zwischen Ubichinon und C. c. Es ist sehr fest an die Mitochondrienmembran gebunden (Ablösung nur durch Detergenzien). C. b ist ein dimeres Protein (Mr 60 kDa) mit je einer Hämgruppe/Monomer, deren zentrales Fe-Atom wie beim C. c nicht autoxidabel ist und nicht mit CO oder Cyanid reagiert. Es existieren Hinweise, dass C. b in zwei verschiedenen Formen, dem C. bK und dem C. bT, vorkommt, die unterschiedliche Redoxpotenziale haben. Dem C. bT wird eine Funktion bei der Energieübertragung in der Elektronentransportkette zugeschrieben.
Ein mikrosomales C. b mit Hämoglobinähnlichkeit ist das C. b5 der Vogel- und Säugetierleber. Man vermutet, dass es Elektronen auf das Fettsäure-Oxygenase-System des endoplasmatischen Reticulums überträgt. Die Hämgruppe ist nichtkovalent über Histidin an das Apoprotein gebunden und reagiert nicht mit O2. Außerdem schützt sie das Cytochrom-b5-Molekül vor Denaturierung und proteolytischem Angriff. Das durch Detergensbehandlung gelöste C. b5 ist ein Oligomer (Mr 120 kDa), das aus mehreren Monomeren (Mr 16kDa; 126 Aminosäuren) besteht. Durch Protease- und/oder Lipasebehandlung abgelöstes C. b5 enthält nur 82 (Schwein), 83 (Huhn), 87 (Mensch, Affe), 93 (Kalb) oder 98 (Kaninchen) Aminosäuren bekannter Sequenz (Mr 10-11kDa) und Tertiärstruktur (50 % α-Helix-, 25% β-Faltblattstruktur).
Andere C. b sind das lösliche C. b562 von Escherichia coli (110 Aminosäuren, Mr 12kDa, Sequenz und Hämbindung sind myoglobinähnlich), das das höchste Redoxpotenzial aller bekannten C.-b-Typen besitzt; ferner die oligomeren C. b6 und C. b559 aus den Chloroplastengranula höherer Pflanzen. Sie können nur durch kombinierte Behandlung mit dem neutralen Detergens Triton X-100→ (0,1%ig) und dem Proteindissoziationsmittel Harnstoff (4M) von der Membran in desaggregierter Form abgelöst werden. Beide sind Bestandteil der photosynthetischen Elektronentransportkette. Die C. b1 (Mr 265kDa, Monomer 64kDa) aus Escherichia coli und C. b2 (Mr 235kDa, Monomer 60 kDa) aus Hefe sind Tetrameremit Dehydrogenase-Aktivität.
Gleichfalls zum Cytochrom-b-Komplex gehört das Cytochrom P450, eine mischfunktionelle mitochondriale Oxidase.
Cytochrom c ist das häufigste und zugleich am besten untersuchte C. (C. c der Wirbeltiere 104 Aminosäuren, Mr 12,4kDa; C. c der höheren Pflanzen 111 Aminosäuren, Mr 13,1kDa). Es kommt als zentraler Bestandteil der Atmungskette in den Mitochondrien aller Eukaryonten vor. Die Hämgruppe (Abb. 1) ist an das Apoprotein über zwei Thioetherbindungen zu Cysteinresten im Innern des Moleküls gebunden. Das Eisenatom ist mit zwei weiteren verborgenen Resten, dem Methionin 80 und Histidin 18, verbunden, wodurch erreicht wird, dass das Eisen des nativen C. c weder mit Sauerstoff noch mit anderen hämkomplexierenden Agenzien, z.B. Kohlenmonoxid, reagiert. Dagegen sind die C.-c-Aggregate biologisch inaktiv und autoxidabel. Durch Zusatz von Guanidin × HCl werden sie desaggregiert und gleichzeitig reaktiviert. Weiterhin haben alle C. c aus höheren Pflanzen bzw. Wirbeltieren, deren Sequenz bekannt ist, am N-terminalen Ende keine freie Aminogruppe, sondern N-Acetylalanin bzw. N-Acetylglycin.
Die Primärstrukturen von über 50 phylogenetisch entfernten Spezies des C. c wurden verglichen. Die Moleküle sind evolutionär extrem konserviert. Eine Gegenüberstellung aller bisher bekannten Cytochrom-c-Strukturen ergibt 35 invariante Reste (33%), die sich größtenteils auf zwei Teilsequenzen, 17 bis 32 und 67 bis 80 (konstante Region), verteilen. Dieser hohe evolutionäre Konservatismus zeigt sich auch beim Vergleich der Kettenkonformation. Bemerkenswert sind die bisher bei keinem anderen globulären Protein beobachteten starken Konformationsunterschiede zwischen der Eisen(II)-Form (kompakte Struktur) und Eisen(III)-Form (lockere, öltropfenähnliche Gestalt) des C. c. Die Übereinstimmungen in der Primär- und Tertiärstruktur, z.B. zwei größere α-Helixabschnitte nur am N- und C-Terminus, lassen sich auch auf die prokaryontischen C. c2 und c550 (137 Reste) von Rhodospirillum bzw. Micrococcus ausdehnen (Abb. 2).
Außer dem mengenmäßig vorherrschenden C. c enthalten die Eukaryonten ein zweites mitochondriales C. c1. Es unterscheidet sich vom klassischen C. c durch seine Unlöslichkeit, sein größeres Molekulargewicht (Mr 37kDa) und seine andersartige Aminosäurezusammensetzung. C. c1 ist Bestandteil der Cytochrom-c-Reduktase.
Bakterielles C. c hat Ähnlichkeit mit eukaryontischem C. c, reagiert jedoch nicht mit der Säugetier-Cytochrom-Oxidase. Folgende bakterielle C. c sind bekannt: 1) Cytochrom c2 (112 Reste, Mr 13,5kDa, pI 6,3, Primär- und Raumstruktur ermittelt) von Rhodospirillum rubrum; 2) Cytochrom c3 (102, 107 bzw. 111 Reste, abweichende Primärstruktur, zwei Hämgruppen) aus Desulfovibrio und anderen sulfatreduzierenden Bakterien; 3) Cytochrom c4 (Mr 24kDa, ein Dimer mit zwei Hämgruppen) sowie 4) Cytochrom c5 (Mr 24,4kDa, ein Dimer) aus Azotobacter; 5) Cytochrom c5 aus Pseudomonas (87 Aminosäuren, Mr 10,1kDa, Sequenz ermittelt) ist ein saures Protein; 6) Cytochrom cc' (Monomer, durch Guanidinbehandlung des Dimeren erhältlich: 125 Aminosäuren, Mr 14kDa, zwei Hämgruppen) aus Chromatium und 7) Cytochrom c' (127 Aminosäuren, ist der Primärstruktur des Cytochroms cc' sehr ähnlich) aus Alcaligenes, beides sind photosynthetische Bakterien; 8) Cytochrom c551 (82 Aminosäuren, Mr 9,6kDa, Primärstruktur von fünf Arten bekannt, saures Protein), ein Elektronencarrier der Nitrit-Reduktasen aus Pseudomonas; 9) Cytochrom c553 (82 Aminosäuren, Mr 9,6kDa, basisch, Sequenz bekannt) und 10) Cytochrom c555, auch Cytochrom c6 oder f genannt, sind Bestandteile der Sulfid-Reduktasen aus grünen Schwefelbakterien. C. f findet sich außerdem in den Chloroplastenmembranen von Geißeltierchen (Euglena gracilis) und in höheren Pflanzen, wo es mit C. b559 beim Elektronentransport in der Photosynthese mitwirkt. C. f aus Spinat (Mr 270 kDa) besteht aus acht Untereinheiten (Mr 34kDa), von denen nur vier eine Hämgruppe haben. C. f aus Euglena gracilis (pI 5,5, Mr 13,5kDa) ist dem C. c funktionell ähnlich.
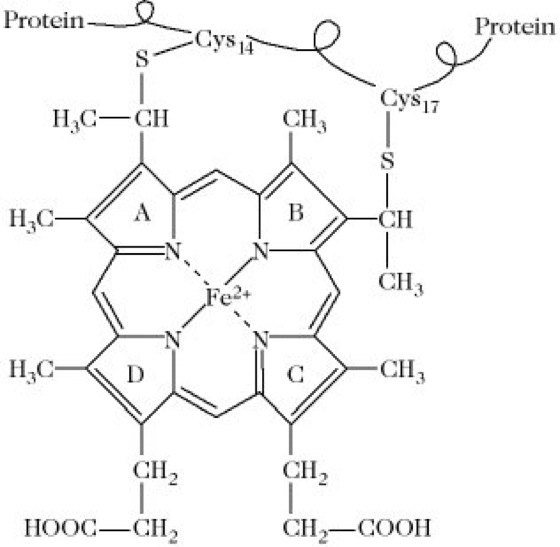
Cytochrome.Abb. 1. Prosthetische Gruppe der Cytochrome c.
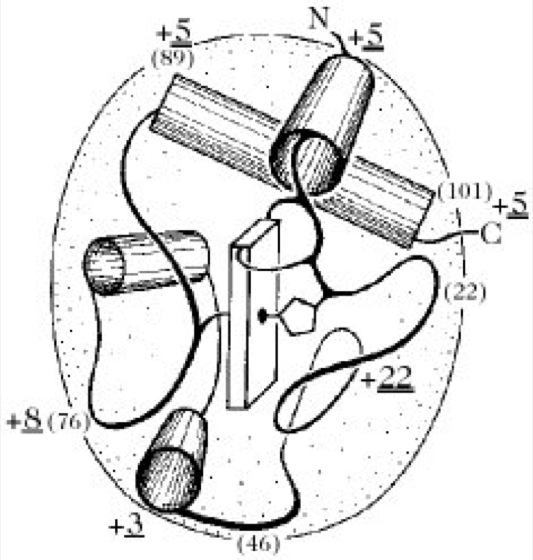
Cytochrome.Abb. 2. Polypeptidkettenfaltung des Wirbeltier-Cytochroms c (104 Reste) und der bakteriellen Cytochrome c2 (112 Reste) und c550 (137 Reste). Die Zylinder repräsentieren die α-Helixabschnitte, die Platte das Häm mit seinen beiden Liganden und die Zahlen in Klammern die Aminosäurereste im Pferde-Cytochrom. c +3, +8, +5 sowie +10 geben die Stellen der Insertionen bei c2 (einfach unterstrichen) bzw. c550 an.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.