Lexikon der Biochemie: DNA-Synthese
DNA-Synthese, Synthese von Oligodesoxyribonucleotiden mit spezifischer Basensequenz unter Einsatz chemischer Methoden. Bei der ursprünglichen Phosphodiestermethode wird das 5'-Phosphat des einen Nucleotids (dessen andere funktionellen Gruppen geschützt sind) mit dem 3'-Hydroxyl eines anderen geschützten Nucleotids kondensiert (Abb. 1). Die Reaktionszeiten sind lang und die Ausbeute nimmt mit der Länge der synthetisierten Kette rasch ab. Diese Methode ist historisch gesehen wichtig, da sie für die erste Totalsynthese eines Gens, eines biologisch funktionellen Suppressor-tRNA-Gens, angewandt wurde. [H.G. Khorana Science203 (1979) 614-625]
Die Phosphotriestermethode überwindet einige Nachteile der Phosphodiestermethode, da während der Synthese der benötigten Sequenz jede als Zwischenstufe auftretende Phosphodiesterfunktion blockiert wird. Diese Methode wurde zur Synthese von 67 verschiedenen Oligonucleotiden mit Kettenlängen von 10-20 bp eingesetzt, die dann zusammengefügt wurden, um ein α-Interferongen mit einer Kettenlänge von 517 Basenpaaren herzustellen [M.D. Edge et al. Nature292 (1981) 756-762]. Die Reaktionen können in Lösung durchgeführt werden (Abb. 2), jedoch ist eine Festphasensynthese effizienter (Abb. 3).
Bei der Festphasensynthese wird das Oligodesoxyribonucleotid synthetisiert während es kovalent an einen festen Träger gebunden ist. Damit jede Synthesestufe vollständig abläuft, wird mit einem Überschuss an gelösten, geschützten Nucleotiden und Kopplungsreagenzien gearbeitet. Die Festphasensynthese ist leicht automatisch durchzuführen. Für diesen Zweck werden technisch fortschrittliche Flüssigkeitsverteilungsgeräte eingesetzt, bei denen die Beschickung des festen Trägers mit Reagenzien mit Hilfe von Computern gemessen und reguliert wird.
Die moderne Methode der Wahl (manuell oder automatisiert) ist ein Festphasensystem, das die Phosporamiditchemie einsetzt (Abb. 4). Die fortschrittlichsten automatisierten Systeme verwenden β-Cyanoethylamidit anstelle von Methylamidit. Die Cyanoethylschutzgruppe verhindert die potenziell mögliche Thyminmethylierung durch Internucleotidmethylphosphat, zu der es bei der Verwendung von Methylamidit kommen könnte. Darüber hinaus lässt sich die Cyanoethylgruppe wieder leichter entfernen als die Methylgruppe, so dass die Entfernung des schützenden Phosphats, die Schutzgruppenentfernung von den Basen und die Abspaltung vom festen Träger in einer einzigen Stufe durchgeführt werden können.
Der feste Träger kann entweder aus Glas mit regulierter Porengröße oder Silica (Phosphoramiditmethode) bzw. aus Polystyren-divinylbenzen (Phosphotriestermethode) bestehen. Die Nucleotide sind über einen Succinylrest an das Aminoende eines Spacerarms des festen Trägers gebunden (Abb. 5). Das Produkt der chemischen DNA-Synthese ist ein einsträngiges Oligonucleotid. Mit Hilfe geeigneter enzymatischer Methoden (rekombinante DNA-Technik) können kurze Oligonucleotide in vitro in die doppelsträngige Form überführt werden. Für die Synthese sehr langer doppelsträngiger DNA (z.B. eines ganzen Gens) können von beiden Strängen überlappende Oligonucleotide synthetisiert werden, die dann zum gesamten Polynucleotid durch Basenpaarung aneinandergereiht und mit Hilfe von Ligase zusammengesetzt werden (Abb. 6). [R.L. Letsinger u. W.B. Lunsford J. Amer. Chem. Soc. 98 (1976) 3.655-3.661; N.D. Sinha et al. Nucleic Acids Res. 12 (1984) 4.539-4.557; R. Newton Internat. Biotech. Lab. 5 (1987) 46-53]
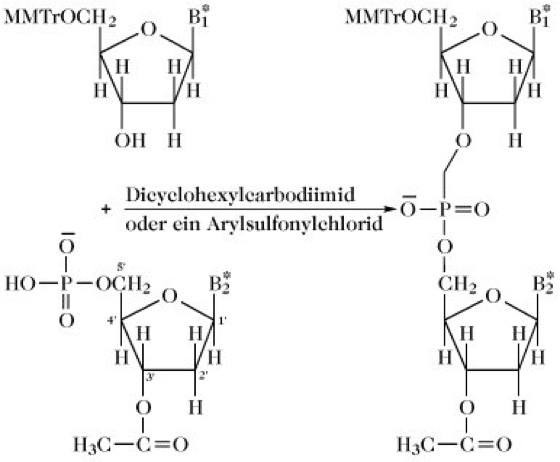
Abb. 1. DNA-Synthese. Prinzip der Phosphodiestermethode zur DNA-Synthese. B* = geschützte Base. MMTr = Monomethoxytrityl.
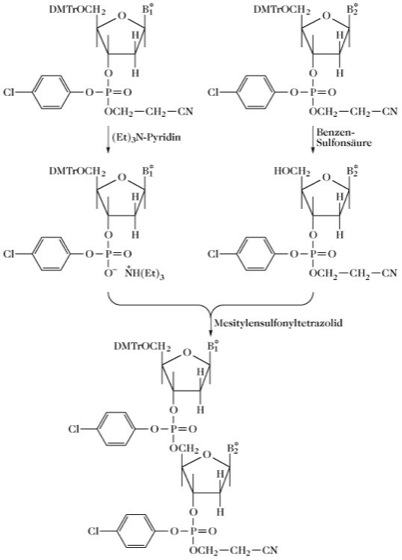
Abb. 2. DNA-Synthese. Die Phosphotriestermethode zur DNA-Synthese. B* = geschützte Base. DMTr = Dimethoxytrityl.
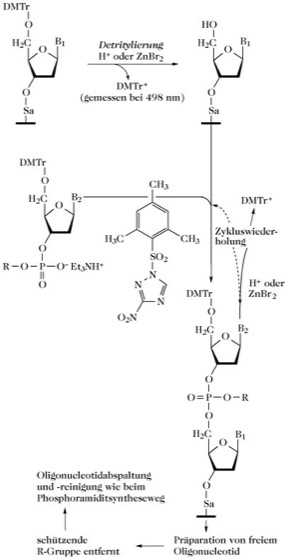
Abb. 3. DNA-Synthese. Phosphotriestemethode zur DNA-Synthese in einem Festphasensystem. Die leuchtend orangene Farbe (λmax 498nm) des DMTr-Kations kann dazu verwendet werden, die Kopplungseffizienz zwischen den Synthesezyklen zu bestimmen. Sa = Spacerarm. B1, B2 = geschützte Basen. Die Kondensation wird durch Mesitylen-2-sulfonyl-3-nitro-1,2,3-triazol aktiviert. R ist eine Phosphorylschutzgruppe.
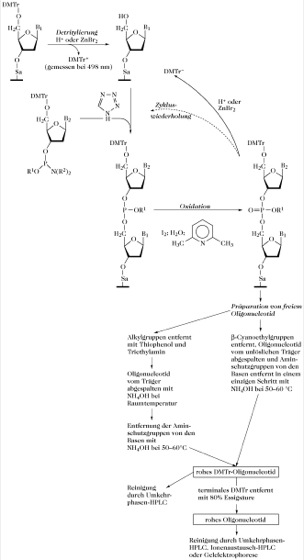
Abb. 4. DNA-Synthese. Phosphoramiditmethode zur DNA-Synthese in einem Festphasensystem. Die Kopplungseffizienz wird durch die Bestimmung des DMTr-Kations gemessen, wie bei der Phosphotriestermethode in Abb. 3. R1 ist eine Methyl- bzw. λ-Cyanoethylgruppe. R2 ist Methyl, Ethyl oder Isopropyl. Sa = Spacerarm. Das reaktive Phosphit wird durch wässriges Iod in der Gegenwart von Lutidin zu einem stabilen Triester oxidiert. Zu Beginn jedes neuen Zyklus werden die trägergebundenen 5'-Hydroxylgruppen, die nicht reagiert haben, mit Hilfe von Acetanhydrid acetyliert. Dieses Verfahren wird Capping genannt.
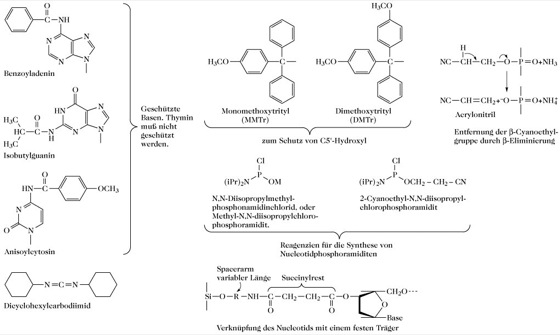
Abb. 5. DNA-Synthese. Einige Strukturen und Reagenzien der chemischen DNA-Synthese.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.