Lexikon der Biochemie: Footprinting
Footprinting, eine Methode zur Identifizierung spezifischer Proteinbindungsstellen auf der DNA (z. B. Bestimmung von Promotorsequenzen der DNA, die die RNA-Polymerase binden, Pribnow-Box.
Unter Versuchsbedingungen wird ein Strang der DNA am 5'-Ende mit 32P markiert (rekombinante DNA-Technik) und dann in vitro mit dem DNA-bindenden Protein inkubiert. Das bindende Protein kann entweder in gereinigter Form eingesetzt werden oder die endmarkierte DNA kann mit einer rohen Mischung von Proteinen versetzt werden, die das in Frage kommende Protein enthält, beispielsweise mit einem Zellkernextrakt. Es sind zwei alternative Techniken möglich: 1) die DNase-I-Technik, die darauf basiert, dass der Bereich, an den das Protein bindet, vor dem Angriff durch DNase I geschützt wird; 2) die Dimethylsulfat-(DMS)-Technik, bei der genutzt wird, dass der Bereich, an den das Protein bindet, nicht durch DMS methyliert werden kann.
Bei der DNase-I-Technik wird die mit Protein komplexierte, endmarkierte DNA mit DNase I unter milden, regulierten Bedingungen inkubiert, so dass im Durchschnitt nur eine Spaltungsstelle ("Nick") je DNA-Molekül entsteht. Zur Kontrolle wird eine Probe der gleichen endmarkierten DNA, die nicht mit Protein komplexiert wurde, auf ähnliche Weise mit DNase I behandelt. Beide DNA-Proben werden denaturiert und nebeneinander in einem Sequenzierungsgel einer Elektrophorese unterworfen (die Fragmente werden nach der Größe getrennt). Die Autoradiographie der Gele zeigt, dass die Kontroll-DNA zufällig gespalten wurde und eine nicht unterbrochene Leiter an radioaktiven Nucleotiden erzeugt hat. Das Autoradiogramm der DNase-I-verdauten, proteinkomplexierten DNA weist eine ähnliche, jedoch unterbrochene Leiter auf (d. h. die Nucleotidenleiter enthält eine Lücke bzw. einen Footprint), weil bestimmte potenzielle Spaltungsstellen durch das gebundene Protein vor der DNase-Wirkung geschützt werden (Abb.). Alle Banden der vollständigen Leiter besitzen das gleiche 5'-Ende. Sie entsprechen den Spaltungsprodukten, die sich um jeweils ein Nucleotid unterscheiden und vom 5'-Mononucleotid bis zu den Nucleotiden reichen, die n – 1 und am Schluss n Nucleotidreste enthalten, wobei n die Gesamtzahl der Nucleotidreste in einem DNA-Einzelstrang (bzw. die Anzahl der Basenpaare in der ursprünglichen doppelsträngigen DNA-Probe) ist. Jede DNA-Verdauungsprobe enthält mehr als n Nucleotide, da zusätzlich die Fragmente vorhanden sind, die entweder das 3'-Ende enthalten oder denen die 3'- und 5'-Enden fehlen. Durch die Autoradiographie werden jedoch nur die Spaltprodukte erfasst, die das 5'-Ende besitzen. Deshalb ist es nicht nur möglich, die relative Lage des Proteins auf der DNA zu bestimmen, sondern auch die vollständige Nucleotidsequenz der DNA und die Identität der Nucleotidsequenzen, die durch das Protein geschützt werden (Nucleinsäuresequenzierung).
Bei der Dimethylsulfat-(DMS)-Technik wird das endmarkierte DNA-Segment mit DMS behandelt, an seinen methylierten G-Resten chemisch gespalten und die erhaltenen Fragmente elektrophoretisch getrennt (Nucleinsäuresequenzierung). Wie beim zuvor beschriebenen Verfahren, bestimmen die Lücken und Footprints im Autoradiogramm die Lage und die Natur der DNA-Sequenzen, die das in Frage kommende Protein binden.
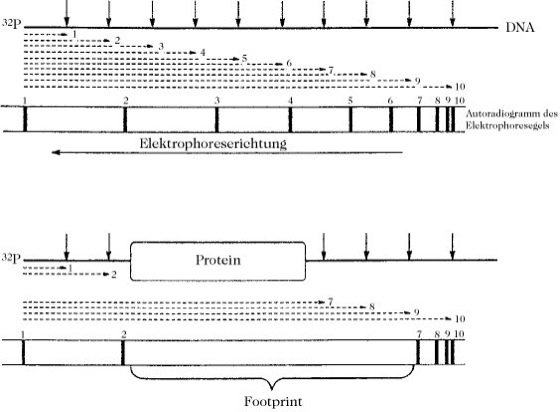
Footprinting. Schematische Darstellung der DNase-I-Technik des Footprintings.
↓ Spaltungsstelle der DNase I.
– - – → 1,
- – - – → 2,
- – - – - → 3
usw. entsprechen den DNA-Fragmenten, die sich vom 32P-markierten Ende bis zur Spaltungsstelle erstrecken.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.