Lexikon der Biochemie: Glycogen-Phosphorylase
Glycogen-Phosphorylase, ein Enzym des Glycogenstoffwechsels, das terminale α(1→4)-glycosidische Bindungen zwischen zwei Glucoseresten im Glycogen phosphorolytisch unter Bildung von Glucose-1-phosphat (Cori-Ester) spaltet. Die G. spaltet wiederholt vom nichtreduzierenden Ende bis zu einer Stelle, die noch vier Glucosereste von einem α(1→6)-Verzweigungspunkt entfernt ist. Für die Katalyse ist Pyridoxal-5'-phosphat (PLP, Pyridoxalphosphate) erforderlich, dessen Aldehydgruppe mit einer spezifischen Lysinseitenkette des Enzyms eine Schiffsche Base ausbildet. Das 5'-Phosphat des PLP tritt mit dem reagierenden Orthophosphat in Form eines allgemeinen Säure-Base-Katalysators in Wechselwirkung (Abb. 1). Das als Zwischenprodukt auftretende Carbeniumion wird von Orthophosphat angegriffen, wobei α-Glucose-1-phosphat gebildet wird. Die phosphorolytische Spaltung, die zu einem phosphorylierten Produkt führt, erfordert den vollständigen Ausschluss von Wasser im aktiven Zentrum der G. Damit erklärt sich die spezielle Funktion des PLP als allgemeiner Säure-Base-Katalysator. Die G. wird durch allosterische Wechselwirkungen und reversible Phosphorylierung reguliert. Im Skelettmuskel kommt die G. in zwei Formen vor. Neben der katalytisch aktiven Form, kurz Phosphorylase a genannt, kommt noch die normalerweise im ruhenden Muskel inaktive Form, die Phosphorylase b, vor. Die monomere Untereinheit der G. besteht aus 841 Aminosäurebausteinen (Mr 97kDa) und faltet sich kompakt zu zwei Domänen. Die aminoendständige Domäne aus 480 Aminosäurebausteinen enthält die glycogenbindende Einheit (60 Aminosäurereste), während die carboxylendständige Domäne aus 361 Aminosäureresten aufgebaut ist. Das aktive Zentrum des Enzyms ist in einer tiefen Spalte, die von den beiden Domänen gebildet wird, lokalisiert. Dadurch ist es vom wässrigen Milieu abgeschirmt. Die PLP-Bindungsstelle befindet sich zwangsläufig in unmittelbarer Nachbarschaft (Abb. 2). Die Glycogenbindungsstelle ist etwa 3nm vom aktiven Zentrum entfernt. Dieser relativ große Abstand ermöglicht der G. viele endständige Reste des verzweigten Glycogens phosphorolytisch abzuspalten. Die Regulation der G. erfolgt sowohl durch reversible Phosphorylierung des Ser14 in beiden identischen Untereinheiten des Dimers als auch allosterisch (Allosterie) durch den Effektor AMP. Die Phosphorylase b des Muskels ist nur in Gegenwart hoher Konzentrationen des allosterischen Effektors AMP aktiv. Als negative allosterische Effektoren wirken ATP und Glucose-6-phosphat. In der Regel ist unter physiologischen Bedingungen im ruhenden Muskel die Phosphorylase b inaktiv. Im arbeitenden Muskel wird der AMP-Spiegel erhöht und dadurch kommt es zur Aktivierung der Phosphorylase b. Erhöhter Adrenalinspiegel (Adrenalin) und elektrische Muskelreizung führen über die kovalente Phosphorylierung zur Bildung der hochaktiven Phosphorylase a. Die Regulation der Leber-Phosphorylase unterscheidet sich von der des Muskelenzyms. Die G. der Leber wird nicht durch AMP aktiviert, außerdem wird die Phosphorylase a der Leber durch Bindung von Glucose inaktiviert. Da in der Leber der Sinn des Glycogenabbaus darin besteht, Glucose bei niedrigem Blutglucosespiegel für den Transport in andere Gewebe bereitzustellen, kann das Leberenzym auf Glucose reagieren.
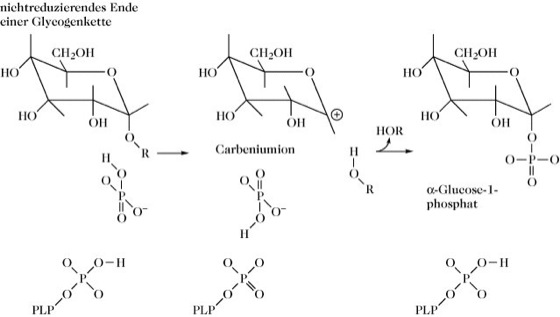
Abb. 1. Glycogen-Phosphorylase. Postulierter Mechanismus der Katalyse der Glycogen-Phosphorylase. R = Rest des Glycogens, PLP = Pyridoxalphosphat, HOR = um einen Glucoserest verkürzte Glycogenkette.
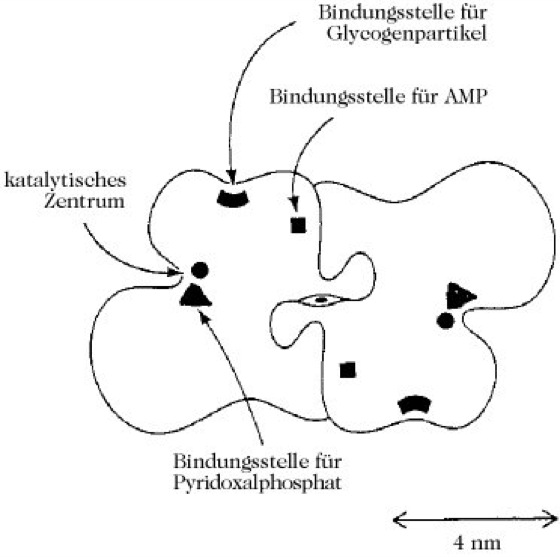
Abb. 2. Glycogen-Phosphorylase. Schematische Darstellung des Phosphorylase-b-Dimers.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.