Lexikon der Biochemie: Glycoproteine
Glycoproteine, Proteine mit kovalent gebundenem Oligosaccharid. Der Proteinteil der G. wird von der mRNA translatiert und die Addition des Oligosaccharids ist eine posttranslationelle Modifizierung. Dies steht im Gegensatz zu den Peptidoglycanen (Murein), bei denen das Kohlenhydratrückgrat strukturell dominiert und durch relativ kurze Polypeptidsequenzen quervernetzt wird, die unabhängig von mRNA und Ribosomen synthetisiert werden. G. kommen in Pflanzen und Tieren, jedoch nicht in Bakterien vor (eine bemerkenswerte Ausnahme stellt ein G. von Halobacterium dar, s. u.). Die meisten G. werden entweder in Köperflüssigkeiten sezerniert oder sind Membranproteine. Zu ihnen gehören viele Enzyme, die meisten Proteinhormone, Plasmaproteine, alle Antikörper, Komplementfaktoren, Blutgruppen- und Mucuskomponenten und viele Membranproteine. Die Polypeptidketten der G. tragen im Allgemeinen eine Reihe von kurzen Heterosaccharidketten und diese enthalten fast immer N-Acetylhexamine und Hexosen (gewöhnlich Galactose und/oder Mannose, seltener Glucose). Das letzte Glied der Kette besteht sehr häufig aus Sialinsäure oder L-Fucose. Die Oligosaccharidketten sind oft verzweigt und setzen sich selten aus mehr als 15 Monomeren zusammen (gewöhnlich 2-10 Monomere, entsprechend einem Mr von 540-3.200 Da). Die Anzahl der Saccharidketten auf einem Polypeptid ist sehr unterschiedlich; Ovalbumin enthält 3% Saccharid, während das Schaf-Submaxillaris-G. zu 50 % aus Kohlenhydrat besteht. Die Sequenzen der Zuckermonomere werden durch die Spezifität der Glycosyl-Transferasen bestimmt und möglicherweise auch durch die Konzentrationen der verfügbaren aktivierten Zucker. Folglich weisen die G. Mikroheterogenität in ihren Saccharidteilen auf.
Eigenschaften und Funktionen. Aufgrund ihrer hohen Viskosität haben die G. eine Schmier- und Schutzfunktion, z. B. gegen proteolytische Enzyme, Bakterien und Viren. Sie spielen eine Rolle in der zellulären Adhäsion und der Kontakthemmung beim Wachstum von Zellen in Gewebekulturen und sind auch für die zelluläre Erkennung von fremdem Gewebe verantwortlich.
Die G. sind wesentliche BestandteileGaer Rezeptoren für Virus- und Pflanzenagglutinine und für Blutgruppensubstanzen. Zu den G. gehören Siderophiline und Ceruloplasmin. Einige G. sind Membrantransportproteine. Für die biologische Aktivität der Gonadotropinhormone ist der Kohlenhydratteil essenziell; in vielen Fällen inaktiviert die selektive Entfernung der terminalen Sialinsäurereste das Hormon. Das Kohlenhydrat dient offensichtlich als Marker für die Erkennung durch einen Rezeptor.
Die G. werden am rauen endoplasmatischen Reticulum (ER) synthetisiert und die wachsende Polypeptidkette streckt sich durch die Membran der cytoplasmatischen Seite aus. In den Zisternen des endoplasmatischen Reticulums werden Zuckereinheiten an die Kette addiert, wodurch verhindert wird, dass sie durch die Membran zurückkehrt. Im Fall der N-Glycane (s. u.) wird im ER ein Standardkomplement an Zuckern addiert, das aus zwei N-Acetylglucosamin-, neun Mannose- und drei Glucoseeinheiten besteht. Vesikel, die aus dem ER erwachsen, transportieren die G. zum Golgi-Apparat, wo einige Zuckereinheiten abgespalten und andere addiert werden, um die für das Protein passende Struktur zu bilden. Das gereifte G. kann ausgeschieden, zu einem der Zellorganellen transportiert bzw. in die Zellmembranen inkorporiert werden.
Die kovalente Protein-Kohlenhydrat-Bindung kann entweder N-glycosidisch oder O-glycosidisch sein. N-glycosidisch gebundene Oligosaccharide werden N-Glycane und O-glycosidisch gebundene Oligosaccharide O-Glycane genannt.
N-glycosidische Bindung. Bei Tieren und Pflanzen ist nur eine Art von N-glycosidischer Bindung in G. bekannt. Diese liegt zwischen dem Amidstickstoff eines Asparaginrests und dem C1 eines N-Acetylglucosaminrests (GlcNAc) vor (Abb. 1). Ein sulfatiertes G. in der Zellwand von Halobacterium enthält zwei Arten an Kohlenhydraten: 1) ein sulfatiertes, repetitives, hochmolekulares Saccharid, das Ähnlichkeit mit einem tierischen Glycosaminoglycan hat, und 2) ein sulfatiertes, niedermolekulares Saccharid mit der Zusammensetzung 1 Glucose : 3 Glucuronsäure : 3 Sulfat. In dieser Verbindung ist die Glucose N-glycosidisch mit dem Amidstickstoff eines Asparaginrests verknüpft. Sie ist die erste, in der eine Asparaginglucosebindung in einem G. gefunden wurde.
Die meisten N-Glycane enthalten einen gemeinsamen Kern (Abb. 2). Jede terminale Mannose der Kernstruktur wird als Antenne betrachtet, die verlängert werden kann. Wenn jede endständige Mannose mindestens einen GlcNAc-Rest trägt, spricht man von einer komplexen antennenartigen Struktur. Wenn eine Mannose des Kernbereichs durch GlcNAc substituiert ist und die andere durch Mannosereste verlängert wird, entsteht ein Hybrid mit einer zweifachen Antenne. Durch die Verknüpfung einer kernterminalen Mannose mit mehr als einem GlcNAc bilden sich Strukturen mit dreifacher, vierfacher usw. Antenne. Eine zweigeteilte antennenartige Struktur weist einen GlcNAc-Rest auf, der mit der zentralen Mannose des Kerns β1→4 verknüpft ist (Abb. 4).
Biosynthese der N-Glycane. Auf dem Lipidcarrier Dolicholphosphatwird zuerst eine große Vorstufe des Oligosaccharids synthetisiert. Die Glycansynthese wird durch die Übertragung von GlcNAc von Uridindiphosphat-N-acetylglucosamin (UDPGlcNAc) auf Dolicholphosphat initiiert, wobei Dolichol-N-acetylglucosaminylpyrophosphat gebildet wird. Wie in Abb. 3 dargestellt, erfolgt die Anknüpfung von α-Mannosyl- und letztlich Glucoseeinheiten in einem geordneten Prozess, der möglicherweise getrennte, spezifische Mannosyl- und Glucosyltransferasen für jede Stufe benötigt. Das gesamte Endprodukt wird auf einen spezifischen Asparaginrest eines Polypeptidakzeptors übertragen (unter Freisetzung von Dolicholpyrophosphat). Als Akzeptoren fungieren sowohl kleine Peptide, die Asparagin enthalten, als auch native Proteine. Das beteiligte Enzym ist für die Struktur -Asn-X-Ser (oder Thr)- spezifisch, wobei X jede Aminosäure sein kann, außer Prolin und möglicherweise Asparaginsäure. Die Aminogruppe von Asn und die Carboxylgruppe von Ser (oder Thr) müssen in einer Peptidbindung vorliegen bzw. auf andere Weise blockiert sein.
Die Prozessierung (im Golgi-Apparat) beginnt mit der Entfernung der drei Glucosereste durch spezifische α-Glucosidasen. Anschließend werden durch spezifische α-Mannosidasen, die für alle mannosereichen Strukturen verantwortlich sind, auf die man in Glycanen stößt, α-Mannosereste geordnet abgespalten.
Komplexe und antennenartige N-Glycane leiten sich von der (Man)5 mannosereichen Struktur durch Reaktionen her, die von der Transferase I [UDP-GlcNAc:α-D-Mannosid (GlcNAc an Manα1-3)-β1-2-GlcNAc-Transferase I] eingeleitet werden.
O-Glycane. In O-Glycanen ist das C1 eines Zuckerrests glycosidisch mit der Hydroxylgruppe der Seitenkette von Serin, Threonin, Hydroxylysin oder Hydroxyprolin verknüpft. In Pflanzenglycanen ist Arabinose, glycosidisch verknüpft mit Hydroxyprolin, weit verbreitet. In anderen Organismen wurde diese Struktur jedoch nicht gefunden. D-Galactose, β-glycosidisch mit Hydroxylysin verknüpft, kommt nur in tierischem Kollagen vor. Das Kollagen enthält auch 2-O-α-D-Glucopyranosyl-D-Galactose, verbunden mit Hydroxylysin. Im Pflanzenglycan Extensin und im Kollagen der Würmer Lumbricus und Nereis findet man Galactose, die mit Serin glycosidisch verknüpft ist. In den G. von Hefen und Pilzen sind die Kohlenhydratketten durch eine glycosidische Bindung zwischen Mannose und Serin oder Threonin gebunden. Diese Bindungsart leistet auch einen kleinen Beitrag zur Glycoproteinstruktur von Säugetieren.
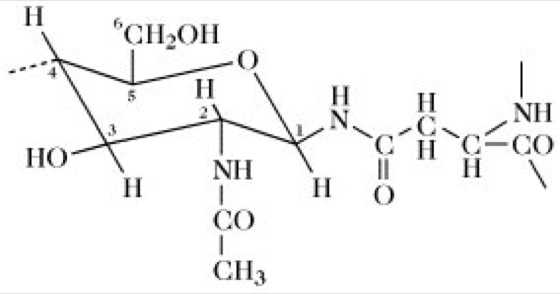
Abb. 1. Glycoproteine. Verknüpfung von N-Acetylglucosamin und einem L-Asparaginrest, repräsentativ für die Bindungsstelle von N-Glycanen in Glycoproteinen.
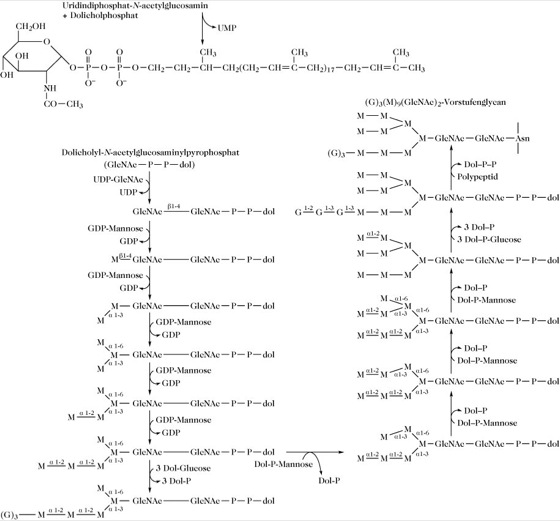
Abb. 3. Glycoproteine. Biosynthese der Vorstufe der asparagingebundenen N-Glycane. Asn = Asparaginrest im Polypeptid; M = Mannosylrest; G = Glucosylrest; Dol-P = Dolicholphosphat; GlcNAc = N-Acetylglucosaminylrest.
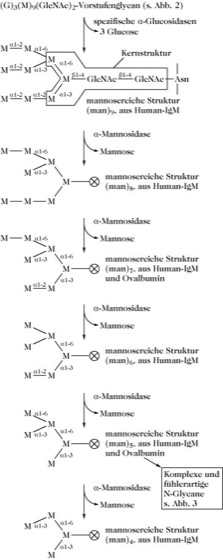
Abb. 2. Glycoproteine. Prozessierung des asparagingebundenen Vorstufenkohlenhydrats. Durch die Entfernung von drei Glucoseresten entsteht die mannosereiche Struktur (Man)9. Bei der anschließenden Entfernung von Mannoseresten werden mannosereiche Strukturen (Man)8 bis (Man)4 gebildet.
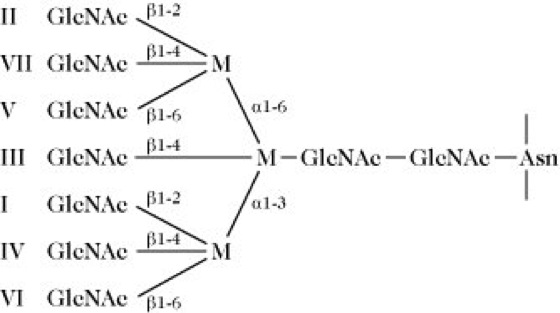
Abb. 4. Glycoproteine. Numerierungssystem für die Antennen und die GlcNAc-Transferasen.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.