Lexikon der Biochemie: Hämoglobinopathie
Hämoglobinopathie, eine angeborene Anormalität der Hämoglobinstruktur, die gewöhnlich durch die Substitution einer einzelnen Aminosäure in den α- oder β-Ketten verursacht wird und das Ergebnis einer Punktmutation im α- oder β-Gen ist. Es sind auch H. bekannt, bei denen Aminosäuredeletionen vorliegen. H. sind angeborene Stoffwechselstörungen. Thalässamienkönnen ebenfalls als H. klassifiziert werden. Viele strukturell anormale Hämoglobine sind klinisch unauffällig. Andere weisen eine erhöhte oder erniedrigte Sauerstoffaffinität auf oder sind instabil. Als Folge der Instabilität kann es zur Bildung von Heinz-Körpernoder Sichelzellen kommen, die Erythrocyten können eine niedrigere Lebensdauer aufweisen oder es können hämolytische Anämien auftreten. Andere funktionelle Defekte, die auftreten können, sind: Mangel an Untereinheitenkooperativität, verminderter Bohr-Effekt und geringere Wirkung des 2,3-Diphosphoglycerats (Hämoglobin). Als Ausgangssuchverfahren für anormale Hämoglobine werden hauptsächlich die Stärkegel- und Papierelektrophorese eingesetzt. Mit der Elektrophorese können nicht alle Mutantenhämoglobine getrennt werden. Die Hinweise auf das Vorhandensein eines anormalen Hämoglobins sind oft physiologischer oder klinischer Natur, z. B. anormale Sauerstoffaffinität, Instabilität, usw. Im Zweifelsfall müssen die α- und β-Ketten des verdächtigen Hämoglobins gereinigt und mit Hilfe konventioneller Verfahren der Proteinsequenzanalyse analysiert werden, um die Stelle der Aminosäuresubstitution zu identifizieren. Für die Bezeichnung des anormalen Hämoglobins (Tab., Teil G) wurde zu Anfang ein Inizialensystem (F = fetal, S = Sickle, M = Methämoglobin) gewählt, bei dem die Buchstaben entsprechend ihrer Entdeckung eingesetzt wurden. In der Tabelle sind einige der bekannten H. aufgeführt. In der Literatur wird regelmäßig über neue H. berichtet. Bisher sind ungefähr 350 verschiedene H. bekannt, wovon ungefähr 150 durch E.R. Huehns in Blood and Its Disorders [R.M. Hardistry u. D.J. Weatherall (Hrsg.), 2. Ausg., Blackwell Scientific Publications, Oxford, 1982] behandelt werden. Das International Hemoglobin Information Center publiziert aktualisierte Listen von anormalen Hämoglobinen in der Zeitschrift Hemoglobin. Weitere Informationen sind auch bei R.G. Schneider "Methods for Detection of Hemoglobin Variants and Hemoglobinopathies in the Routine Clinical Laboratory" RC Critical Review in Clinical Laboratory Sciences (November 1978) zu finden.
Tab. Hämoglobinopathien. Anormale Hämoglobine. Die Namen der anormalen Hämoglobine beziehen sich auf die geographischen Orte, an denen die jeweiligen Hämoglobine erstmals entdeckt wurden. Die Bezeichnung "instabil" kennzeichnet solche Hämoglobine, bei denen in vivo eine beschleunigte Erythrocytenzerstörung und in vitro ein Ausfällen des Hämoglobins beim Erwärmen auf 50 °C auftritt. Zum Numerierungssystem der Reste und zum Vergleich mit normalem Hämoglobin A Hämoglobin.
| |||||
| A-1. Hämoglobine M ( = Methämoglobin). Das Hämeisen ist irreversibel oxidiert, d. h. liegt im Fe(III)-Zustand vor. Das vorliegende Methämoglobin kann durch die Methämoglobin-Reduktase nicht reduziert werden. Es sind fünf Arten bekannt. Nur Heterozygote überleben. | |||||
| Name | Substitution | O2-Affinität | Koopera- tivität | Bohr-Effekt | Bemerkungen |
| Boston | α58(E7)His → Tyr | gering | gering | verringert | dauerhaft in der Desoxyform. |
| Hyde-Park | β92(F8)His → Tyr | hoch | verringert | normal | s. Abb. |
| A-2. Andere Substitutionen in der hämbindenden Region. | |||||
| Hammersmith | β42(CD1)Phe → Ser | gering | leicht erniedrigt | Das polare Ser ermöglicht wahrscheinlich den Eintritt von Wasser in die Hämtasche. | |
| Zürich | β63(E7)His → Arg | hoch | verringert | normal | instabil |
| B. Aminosäuresubstitutionen, die den Kontakt zwischen den α1- und β1-Untereinheiten beeinträchtigen. | |||||
| Heathrow | β103(G5)Phe → Leu | hoch | |||
| Prato | α31(B12)Arg → Ser | normal | normal | normal | |
| C. Aminosäuresubstitutionen, die den Kontakt zwischen den α1- und β2-Untereinheiten beeinträchtigen | |||||
| Hiroshima | β146(C-terminales His) → Asp | hoch | vermindert | Bohrproton kann nicht abgespalten werden | |
| Richmond | β102(G4)Asn → Lys | normal | normal | normal | |
| D. Aminosäuresubstitutionen im Hohlraum zwischen ähnlichen Ketten | |||||
| Jackson | α127(H10)Lys → Asn | keine anormalen Eigenschaften bekannt | |||
| Helsinki | β82(EF6)Lys → Met | niedrig | vermindert | Lys82 ist Diphosphoglycerat-Bindungsstelle | |
| E. Aminosäuresubstitutionen im Innern der Untereinheiten. Austausch einesunpolaren gegen einen polaren Rest im hydrophoben Innern, oder eines kleines Rests gegen einen großen Rest verursacht Instabilität. Insertion von Pro in eine Helix ruft Distorsion (Pro ist ein "Helixbrecher") und Instabilität hervor. | |||||
| Port Phillip | α91(FG3)Leu → Pro | instabil | |||
| Perth | β32(B14)Leu → Pro | hoch | instabil | ||
| F. Aminosäuredeletionen. Alle Hb sind instabil. | |||||
| Freiburg | β23(B5)Gly | hoch | |||
| St. Anton | β74-75(E18-E19)Gly- Leu | normal | |||
| Gun Hill | β91-95(F7-FG2)Leu- His-Cys-Asp-Lys | essenzielle Kontakte mit Häm nicht vorhanden; β-Ketten enthalten kein Häm; hämolytische Anämie. | |||
| G. Aminosäuresubstitutionen auf der äußeren Oberfläche des Moleküls | |||||
| Name | Substitution | Bemerkungen | |||
| Hämoglobin C | β6(A3)Glu → Lys | Relativ weit verbreitet bei Westafrikanern und Menschen westafrikanischer Abstammung. Heterozygote besitzen 30-40 % HbC (+ ca. 60 %HbA) und sind gesund. Homozygote können milde Anämie haben, ihre Lebenserwartung ist normal. | |||
| Hämoglobin D | β121(GH4)Glu → Gln | Relativ häufig bei Schwarzen (0,4%), Algeriern (2,0 %) und Sikhs in Nord- und Zentralindien, tritt in anderen Gruppen sporadisch auf. Homozygote zeigen nur geringe Symptome (Anämie) und die Bezeichnung "Hämoglobin-D-Krankheit" ist wahrscheinlich übertrieben. | |||
| Hämoglobin E | β26(B8)Glu → Lys | s. a. Punkt B. Das zweithäufigste anormale Hb der Welt, das bei Menschen auftritt, die aus Südostasien abstammen. Homozygote zeigen leichte Anämie. | |||
| Hämoglobin J | α115(GH3)Ala → Asp | Kommt in Neu-Guinea vor. Vermutlich keine pathologische Bedeutung. | |||
| Hämoglobin O Arab | β121(GH4)Glu → Lys | Verstärkt bei Heterozygoten mit HbS Sichelzellenbildung. Geringe O2-Affinität bei Homozygoten mit Sichelzellen. Ursprung liegt vermutlich bei nichtarabischen Völkern des präsemitischen Ägyptens. Das Reservoir stellen vermutlich Sudanesen dar, die sich im ottomanischen Reich weit verbreitet haben. Kommt auch vor in Jamaika, Rumänien, Bulgarien und Ungarn. | |||
| Korle Bu | β73(E17)Asp → Asn | Nur von einer Westafrikanischen Familie beschrieben. Homozygoten zeigen normalerweise keine pathologischen Eigenschaften. | |||
| Hämoglobin S (Sichelzellhämoglobin) | Das häufigste anormale Hämoglobin; s. separaten Stichworteintrag. |
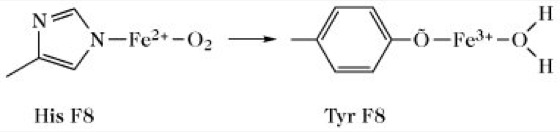
Hämoglobinopathien. Bei der Hämoglobinopathie Hyde Park zerstört der Austausch des hämbindenden His F8 durch Tyr die Fähigkeit des Häms, Sauerstoff zu binden.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.