Lexikon der Biochemie: Immunglobuline
Immunglobuline, Ig, Antikörper, Gammaglobuline, γ-Globuline, zu der Immunglobulin-Großfamilie gehörende Glycoproteine, die als spezifische Komponenten der humoralen Immunantwort fungierenden Antikörper. Sie haben die Aufgabe, durch spezifische Bindung an die Antigene, diese zu markieren und auf diese Weise für Phagocytose, cytotoxische und lytische Reaktionen durch Immunzellen und Komplementproteine zugänglich zu machen. Nach Größe, Kohlenhydratanteil und Aminosäuresequenz erfolgt eine Einteilung in fünf Klassen (Tab.). Die I. besitzten eine einheitliche Grundstruktur. Sie sind aus zwei leichten Ketten, den L-Ketten (Mr 23kDa), und zwei schweren Ketten, den H-Ketten (von engl. heavy; Mr 53-75kDa) aufgebaut. Die vier Ketten werden durch kovalente Disulfidbrücken und nichtkovalente Wechselwirkungen zusammengehalten. Die Antigenbindungsstellen werden von den N-Termini sowohl der leichten als auch der schweren Ketten gebildet. Zur Scharnier (hinge)- und Fuß-Region tragen ausschließlich die schweren Ketten bei, die durch Disulfidbrücken zwischen der CH1 – und CH2-Domäne miteinander verknüpft sind. Die einfachsten I., wie das IgG-Molekül (Abb.1) sind Y-förmige Strukturen. Bei der limitierten Proteolyse des IgG (Mr 150 kDa) mit Papain werden die H-Ketten N-terminal von den Disulfidbrücken gespalten. Dabei entstehen Fab-Fragmente (ab für engl. antigen binding), und ein Fc-Fragment (c für engl. crystallizing). Die Arme des Y-förmigen IgG-Moleküls werden von den Fab-Fragmenten (je Mr 50 kDa) gebildet. Sie bestehen aus einer vollständigen L-Kette und dem N-Terminus der H-Kette, woraus sich die Antigen-Bindungsstelle ("ab") rekrutiert. Die begrenzte Proteolyse mit Pepsin erfolgt C-terminal von den interchenaren Disulfidbrücken und liefert zwangsläufig ein bivalentes F(ab')2-Fragment und ein etwas kleineres Fc'-Fragment. Diese Fragmente haben allerdings die biologischen Eigenschaften der nativen IgG-Moleküle verloren, d. h. sie sind nicht in der Lage, das Komplementsystem zu aktivieren bzw. an FC-Rezeptoren zu binden. I. mit zwei identischen Antigen-Bindungsstellen (Paratopen) werden bivalente Antikörper genannt. Enthält das Antigen drei oder mehr Epitope, dann können die Antikörper Kreuzvernetzungsreaktionen durchführen, wobei eine bewegliche Scharnier-Region die räumliche Anpassungstätigkeit erhöht. Neben den zweiwertigen Antikörpern gibt es auch vielwertige Antikörper, wie z. B. IgA und IgM (vgl. Tab.).
Der Name des Fc-Fragmentes (Mr 50 kDa) bezieht sich auf die leichte Kristallisationstendenz. Es bildet den Stiel des Y-förmigen IgG-Moleküls und ist aus den identischen C-terminalen Teilen der beiden H-Ketten aufgebaut. Darin sind Effektorstellen für gemeinsame Eigenschaften der I. lokalisiert, die für die Induktion der Phagocytose, Auslösen des Komplementsystems und auch für die Steuerung des Transports der I. zu ihrer Wirkungsstelle von Bedeutung sind. Die menschlichen I. lassen sich in fünf Klassen einteilen: IgA, IgD, IgE, IgG und IgM (Tab.). Sie differieren im H-Kettentyp, der in der gleichen Reihenfolge mit α, β, ε, γ und μ bezeichnet wird. Während die I. IgD, IgE und IgG nur als Dimere des Typs (L-H)2 vorliegen, besteht IgM aus Pentameren der entsprechenden Dimere und IgA tritt als Monomer, Dimer und Trimer der zugehörigen Dimere auf. In diesen Multimeren sind die Dimer-Einheiten sowohl untereinander als auch mit der sog. J-Kette über Disulfidbrücken verknüpft. Die J-Kette ist ein verbindendes Protein (J von engl. joining; Mr 20 kDa). Die multimeren Strukturen des IgA-Dimers und von IgM zeigt Abb. 2.
Die physiologischen Funktionen der sezernierten I. sind recht unterschiedlich. IgM ist fast ausschließlich im Blut vorhanden und ist besonders aktiv gegen eindringende Mikroorganismen. Es ist der vorherrschende Antikörper in der frühen Phase einer primären Immunantwort. Als Reaktion auf ein Antigen beginnt seine Produktion zwei bis drei Tage nach dem ersten Kontakt mit dem Antigen. IgM kommt auch membrangebunden auf der B-Zellen-Oberfläche vor und fungiert dort als Antigenrezeptor.
IgG ist der häufigste zirkulierende Antikörper. Er ist der wichtigste Antikörper der sekundären Immunantwort, wenn sich der Körper wiederholt mit dem gleichen Antigen auseinandersetzen muss. Es wird in vier Unterklassen IgG1 bis IgG4 unterteilt, die sich in den γ-Ketten unterscheiden. Wie IgM kann dieser Antikörper das Komplementsystem aktivieren. IgG bindet des Weiteren mit seinem Fc-Teil an entsprechende Rezeptoren auf Monocyten, Makrophagen und Granulocyten und fördert die Phagocytose des gebundenen Antigens. Zur Familie der IgG-I. zählen alle Antitoxine, die in der Lage sind, die in den Körper eingedrungenen Toxine zu neutralisieren. IgG ist zwischen Blut und interstitieller Flüssigkeit recht gleichmäßig verteilt. Es ist der einzige Antikörper, der durch rezeptorvermittelte Endocytose die Plazentaschranke überwinden kann und damit die passive Immunität von der Mutter auf den Fötus überträgt. IgG wird zwei Tage nach dem ersten Auftreten von IgM produziert.
IgA findet sich außer im Serum auch im Verdauungstrakt sowie in Körperflüssigkeiten, wie Speichel, Schweiß, Tränen, Milch, Bronchial- und Urogenitalsekreten, wo es die erste Abwehrlinie bei der lokalen Infektabwehr darstellt. IgA verhindert die Anheftung von Viren und Bakterien an die Oberfläche von Epithelien. Das IgA im Colostrum (die erste Milch einer stillenden Mutter) schützt Säuglinge gegen in den Darm eindringende Krankheitserreger.
IgD kommt im Blut nur in sehr niedrigen Konzentrationen vor. Membranständig auf B-Zellen dient es als Antigenrezeptor und ist notwendig für die Differenzierung der B-Zellen in Plasmazellen und B-Gedächtniszellen.
IgE ist hauptsächlich auf der Oberfläche von Mastzellen und basophilen Granulocyten lokalisiert, wo es über die Schwanzregion gebunden ist. Es spielt eine wichtige Rolle bei der Auslösung allergischer Reaktionen und hat eine Schutzfunktion gegen Parasiten.
L- und H-Ketten der I. bestehen aus einer variablen (V-) und einer konstanten (C-)-Region. Die Myelom-L-Ketten enthalten 214 Aminosäurebausteine. Dimere aus L-Ketten sind die Bence-Jones-Proteine, die bei verschiedenen Patienten unterschiedliche Sequenzen aufweisen. So ist die L-Ketten-Sequenz 1-108 variabel, während der C-terminale Abschnitt (109-214) eine konstante Region darstellt. Auch die H-Kette von Myelom-I. mit 446 Aminosäurebausteinen besteht wie die L-Kette aus einer variablen Region im aminoterminalen Sequenzbereich (1-108) gefolgt von einer dreimal so langen konstanten Region. Sowohl in der L- als auch in der H-Kette kommen drei Segmente einer weitaus größeren Variabilität vor, die die hypervariablen Regionen der Antigenbindungsstellen bilden. Da diese Regionen die Spezifität der Antikörper bestimmen, bezeichnet man sie als komplementaritätsbestimmende Regionen (CDR, von engl. complementarity-determining region). Die Domänenstruktur des IgG (Abb.1) zeigt, dass die variable Region der L-Kette (VL) der variablen Region der H-Kette (VH) ähnelt. Weiterhin besteht die konstante Region der H-Kette aus drei gleichen Teilen (CH1, CH2, CH3) mit teilweise übereinstimmender Sequenz. Auch ist die konstante Region der L-Kette (CL) den drei Domänen der konstanten Region der H-Kette wiederum sehr ähnlich. Schließlich befinden sich in jeder Domäne die intramolekularen Disulfidbrücken an derselben Stelle. Die Ähnlichkeit der homologen Domänen zeigt sich auch in der Tertiärstruktur des Fab' -Fragmentes sowie der Fc-Einheit. Die Vielfalt der variablen Domänen mit unterschiedlicher Antigenbindungsspezifität entsteht durch somatische Rekombination von Gensegmenten sowie durch somatische Punktmutationen in den rekombinierten Genen. Die Rekombination der Gene der I. erfolgt in einer festgelegten Reihenfolge. Zuerst findet in der reifenden B-Zelle eine Umlagerung von Genen im H-Kettenlocus auf einem Chromosom statt. Dabei wird eines der D-Gensegmente mit einem J-Gensegment rekombiniert. Im Anschluss an die D-J-Kombination erfolgt die Verknüpfung des DJ-Segments mit einem V-Gen-Segment, woraus ein funktionelles H-Ketten-Gen resultiert.
I. kommen entweder als membranständige Rezeptoren oder als lösliche Antikörper vor. In der Regel zerstört ein Antikörper ein eindringendes Antigen nicht. Durch die Bildung eines Antigen-Antikörper-Komplexes kommt es zur Auslösung verschiedener Effektormechanismusketten. Am einfachsten ist eine Neutralisation, die dadurch zustande kommt, dass der Antikörper bestimmte Stellen auf einem Antigen blockiert und das Antigen dadurch unwirksam macht. Eine Neutralisation eines Virus durch einen Antikörper erfolgt dadurch, dass sich der Antikörper an die Stelle heftet, die vom Virus an der Wirtszelle zum Andocken genutzt wird. Die Agglutination (Verklumpung) von Bakterien durch Antikörper ist ein weiterer Effektormechanismus. Voraussetzung dafür ist das Vorhandensein von mindestens zwei Antigenbindungsstellen, wodurch benachbarte Antigenmoleküle vernetzt werden können. Phagocytotoxische Zellen können verklumpte Bakterien schneller vernichten als einzelne. Ein ähnlicher Mechanismus ist die Präzipitation. In diesem Fall führt die Vernetzung zu einem unlöslichen Präzipitat, das Phagocyten aufnehmen. Zu den wichtigsten Mechanismen der humoralen Immunantwort zählt die Aktivierung des Komplementsystems. Die im Blut eines immunisierten Tiers gebildeten und daraus gewonnenen Antikörper werden polyklonale Antikörper genannt. Sie werden von verschiedenen B-Zell-Klonen gebildet, von denen jeder Antikörper für ein bestimmtes Epitop des zur Immunisierung verwendeten Antigens spezifisch ist. Jede normale Immunantwort ist polyklonal. Aus einer solchen Mischung einen spezifischen Antikörper zu gewinnen, ist äußerst aufwendig. 1975 wurde durch Köhler und Milstein eine Methode zur Herstellung monoklonaler Antikörper entwickelt. Monoklonal bedeutet, dass bei diesem Verfahren sämtliche antikörperproduzierenden Zellen Abkömmlinge einer einzelnen Zelle sind. [G.M. Edelmann Scientific American223 (1970) 34-42; R.R. Porter Science180 (1973) 713-716]
Tab. Immunglobuline. Einteilung und Eigenschaften der Humanimmunglobuline (Ig).
| ||||||
| Sedimentationskonstante | 6,5-7S | 19S | 7S | 6,8-7,9S | 8,2 | |
| Mr, [kDa], davon L-Kette stets 23kDa | 150 | 950 | 360-720 | 160 | 190 | |
| H-Kettentyp Mr [kDa] | γ 1-γ 4 50-60 | μ 71 | α 64 | δ 60-70 | ε 75,5 | |
| Kettenformel (L = κ oder λ) | L2χ2 | (L2μ2)nJ* | (L2α2)nJ* | (L2δ2)2 | L2ε2 | |
| Kohlenhydrat | 2-3% | 10-12% | 8-10 % | 12,7% | 10-12% | |
| Anteil an den Serum-Ig | 70-75% | 7-10 % | 10-22% | 0,03-1% | 0,05% | |
| Serumkonzentration (mg/100ml) | 1.300 (800-1800) | 140 (60-280) | 210 (100-450) | 3 (1-40) | 0,03 (0,01-0,14) | |
| Valenz der Bindung | 2 | 5 (10) | 1 (Serum) 2 (Plasma) | ? | 2 | |
| biol. Halbwertszeit (Tage) | 8 (IgG3) oder 21 | 5,1 | 5,8 | 2,8 | 2-3 | |
| Komplementbindung | ja | ja | nein | nein | nein |
n = 1, 2 oder 3

Abb. 1. Immunglobuline. Schematische Darstellung des humanen IgG-Moleküls.
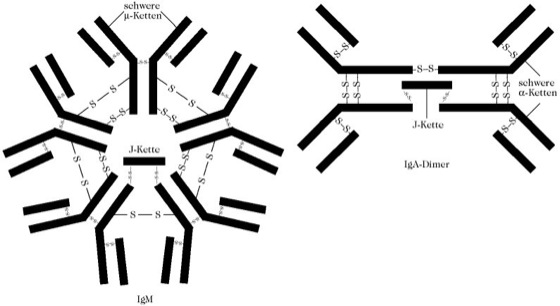
Abb. 2. Immunglobuline. Multimerstruktur von IgM und IgA. Die J-Kette verbindet zwei H-Ketten im Pentamer des IgM; auch im IgA-Dimer sorgt die J-Ketten-Verknüpfung für die Di- und Trimerisierung (hier nicht gezeigt).
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.