Lexikon der Biochemie: Insulin
Insulin, ein aus zwei Peptidketten aufgebautes Peptidhormon. Die A-Kette mit 21 und die B-Kette mit 30 Aminosäureresten wird durch zwei interchenare Disulfidbrücken zu einem bizyklischen System verknüpft, während in der A-Kette eine intrachenare Disulfidbrücke enthalten ist. I. wird in den B-Zellen der Langerhansschen Inseln des Pankreas gebildet und senkt als Gegenspieler des Glucagons bei physiologischem Bedarf den Blutglucosespiegel. Die typischen I.-Mangelsymptome ergeben das Krankheitsbild des Diabetes mellitus, deren Ursachen weitgehend unbekannt sind. I. wurde 1921 durch Banting und Best als Diabetes-kompensierendes Prinzip entdeckt. 1926 gelang Abel die Reindarstellung und Kristallisation und 1955 wurde durch Sanger die Primärstruktur aufgeklärt. Schließlich ermittelte 1969 Dorothy Hodgkin die Raumstruktur durch Röntgenkristallstrukturanalyse. I. wurde lange Zeit industriell durch Extraktion von Pankreata aus Schwein und Rind gewonnen. 1963 gelang den Arbeitskreisen um Helmut Zahn in Aachen, Katsoyannis in Pittsburgh und Chu Wang in Shanghai die Totalsynthese der beiden Ketten und deren Kombination durch statistische Oxidation zum Insulin mit biologischer Aktivität. Der eindeutige Strukturbeweis für die von Sanger vorgeschlagene Primärstruktur (Abb. 1) konnte erst 1974 durch eine von Rittel und Mitarbeitern beschriebene Totalsynthese des Humaninsulins erbracht werden, bei der auch die Disulfidbrücken im Verlauf der Chemosynthese in eindeutiger Weise unter Vermeidung von Disulfidaustausch geknüpft wurden. Aufgrund des hohen Bedarfs an I. (Weltjahresbedarf beträgt gegenwärtig ca. 6 Tonnen mit einem Marktwert von ca. 1,8 Mrd. DM) ist die gentechnische Produktion die Methode der Wahl, obgleich auch die Semisynthese des Humaninsulins aus Schweineinsulin durch enzymatischen Aminosäureaustausch prinzipiell mit den gentechnischen Produktionsverfahren konkurrieren kann, wenn genügend Schweineinsulin durch Extraktionsverfahren bereitgestellt werden könnte. Aufgrund der komplexen Struktur des I. stellt die Chemosynthese keine Produktionsalternative dar. Obgleich Humaninsulin weniger immunogen ist als Schweine- oder Rinderinsulin, konnte es letzteres nicht sofort verdrängen, weil gut eingestellte Diabetiker nicht unbedingt zum Humaninsulinpräparat wechseln müssen. [D. Brandenburg, Insulin Chemistry in Handbook of Experimental Pharmacology Vol. 92, P. Cuatrecas u. S. Jacobs (Hrsg.) Springer-Verlag, Berlin 1990]
I. ist das einzige blutzuckersenkende Hormon. Es beeinflusst den gesamten Intermediärstoffwechsel, speziell von Leber, Fettgewebe und Muskulatur. I. erhöht die Zellpermeabilität für Monosaccharide, Aminosäuren und Fettsäuren, beschleunigt die Glycolyse, den Pentosephosphat-Zyklus und in der Leber die Glycogensynthese. Es fördert die Fettsäure- und Proteinbiosynthese. Diese indirekten Wirkungen auf verschiedene Enzyme und Stoffwechselprozesse sind in den Tabellen 1 und 2 aufgeführt.
Die meisten Arten besitzen nur einen Insulintyp, jedoch liegen bei drei Nagetierspezies (Laborratte, Maus, Spitzmaus) und zwei Fischarten (Thunfisch, Krötenfisch) zwei verschiedene Hormone vor. Die Ratte ist im Besitz von zwei Insulingenen, während bei Menschen nur eines vorhanden ist. Die Ratten- und Humaninsulingene wurden sequenziert [G.I. Bell et al. Nature 284 (1980) 26-32]. Das reife mRNA-Transcript codiert für Prä-Pro-Insulin, das eine aminoterminale hydrophobe, 16 Reste umfassende Signalsequenz trägt (Signalhypothese; Abb. 2). Sobald Prä-Pro-Insulin durch die Membran in das Lumen des endoplasmatischen Reticulums tritt, wird die Signalsequenz entfernt und es entsteht Pro-Insulin. Pro-Insulin wird zum Golgi-Apparat transportiert, wo die proteolytische Entfernung einer internen Sequenz, des Verbindungspeptids (connecting peptide, C-Peptid), begonnen wird. In den Speichergranula wird die Hydrolyse fortgesetzt. Zusätzlich zu anderen Strukturhomologien enthält das C-Peptid verschiedener Arten an seinem Aminoende Arg-Arg und an seinem Carboxyende Lys-Arg. Diese stellen die proteolytischen Spaltungsstellen für den Angriff durch trypsinähnliche Enzyme dar. Die Disulfidbrückenbindungen werden unmittelbar nach der Translation gebildet und sind im Pro-Insulin vorhanden. Das I. wird durch Fusion der Membran reifer Speichergranula mit der Plasmamembran der Zelle freigesetzt (Sekretion). Die Insulinausschüttung, die als Antwort auf Metabolite der Atmung(z. B. Glucose) oder bestimmte Hormone erfolgt, wird durch eine Konzentrationserhöhung von freien cytosolischen Ca2+-Ionen ausgelöst. Die Ca2+-Konzentrationserhöhung wird durch vermehrtes Einströmen von Ca2+ durch spannungsabhängige Ca2+-Kanäle und durch Mobilisierung intrazellulärer Ca2+-Reservoirs verursacht.
Inositoltriphosphat kann als sekundärer Botenstoff für die Freisetzung von Ca2+ aus internen Speichern dienen (Inositolphosphate). Es existiert kein eindeutiger Nachweis dafür, dass dieser Vorgang für die Stimulierung verschiedener sekretorischer Zellen universell sein könnte. [S.K. Joseph et al. J. Biol. Chem. 259 (1984) 12952-12955; C.B. Wollheim u. G.W.G. Sharp Physiol. Rev. 61 (1981) 914-973]
Ein wichtiger physiologischer Stimulus für die Insulinsekretion besteht in einer hohen Blutglucosekonzentration, z. B. in Form der Hyperglycämie, die nach einer Mahlzeit auftritt, und die Insulinsekretion fördert. Weitere primäre physiologische Stimuli der Insulinsekretion sind: Mannose, Leucin, Arginin, Lysin, kurzkettige Fettsäuren, langkettige Fettsäuren, Acetoacetat und β-Hydroxybutyrat. Zu den sekundären physiologischen Stimuli (fördern die Insulinfreisetzung nicht direkt, beeinflussen jedoch die Antwort auf die primären Stimuli) zählen: Glucagon, Sekretin, Pankreozymin, Gastrin, Acetylcholin und Prostaglandin E1 und E2. Die Insulinsekretion wird durch Somatostatin, Adrenalin und Noradrenalin inhibiert. Die Biosynthese und die Sekretion von I. sind mit unterschiedlichen Glucosekonzentrationen gekoppelt. So wird die Insulinsynthese durch Glucosekonzentrationen angeregt, die höher als 2-4mM sind, während zur Insulinsekretion Glucosekonzentrationen oberhalb von 4-6mM erforderlich sind. Die Biosynthese von I. wird auch gefördert von: Mannose, Dihydroxyaceton, Glyceraldehyd, Leucin, N-Acetylglucosamin, α-Ketoisocaproat, Glucagon und Methylxanthinen. Adrenalin inhibiert die Insulinbiosynthese, während Galactose keinen Effekt ausübt. Die Sulfonylharnstoffe, die im Fall der Typ-2-Diabetes (mangelhafte sekretorische Antwort der B-Zellen) zur pharmakologischen Anregung der Insulinsekretion angewandt werden, stimulieren die Insulinbiosynthese nicht.
Das I. wird radioimmunologisch bestimmt. Der Normalwert im Blut beträgt beim Menschen 1ng/ml.
I. wird rasch aus dem Kreislauf entfernt und abgebaut (inaktiviert). Der Hauptabbauort ist die Leber, jedoch besitzen die meisten peripheren Gewebe spezifische insulinabbauende Enzyme. Diese Enzyme sind in den Zellen lokalisiert, so dass das Insulin vor dem Abbau in diese aufgenommen werden muss. Dies geschieht durch rezeptorvermittelte Endocytose. Anschließend dissoziiert das Insulin vom Rezeptor und wird abgebaut, während der Rezeptor vermutlich an die Plasmamembran zurückkehrt. Eine lösliche Insulinprotease greift sowohl das Insulinmolekül als auch die getrennten A- und B-Ketten an. Zusätzlich enthält die Zelle eine Insulinglutathion-Transhydrogenase, die an die intrazellulären Membranen gebunden vorliegt und die Disulfidbindungen von I. spaltet, wodurch getrennte A- und B-Ketten entstehen. Die abbauenden Enzyme werden durch I. stimuliert. Die insulinabbauende Aktivität in der Leber nimmt durch Hungern ab und steigt bei Nahrungsaufnahme wieder an. Ein exzessiver Abbau kann eine Ursache bzw. ein beisteuernder Faktor des Diabetes mellitussein. [W. Montague, Diabetes and the Endocrine Pancreas – A Biochemical Approach Croom Helm, London, 1983; M.P. Czech, Hrsg., Molecular Basis of Insulin Action Plenum Press, New York 1985; L.M. Graves u. J.C. Lawrence, jr. "Insulin, Growth Factors, and cAMP. Antagonism in the Signal Transduction Pathways" Trends Endocrinol. 7 (1996) 43-50]

Abb. 1. Insulin. Primärstruktur des Schafsinsulins. Humaninsulin (H) und Rinderinsulin (R) unterscheiden sich im Sequenzabschnitt A 8-10 vom Schafsinsulin; im Humaninsulin ist darüber hinaus das C-terminale Alanin der B-Kette gegen Threonin ausgetauscht.
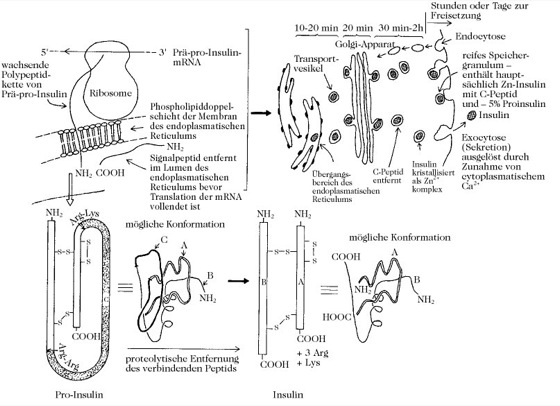
Abb. 2. Insulin. Posttranslationelle Modifizierung (Prozessierung) von Pro-Insulin im Lumen des Endoplasmatischen Reticulums, im Golgi-Apparat und in den Transportvesikeln. Diese Prozesse ereignen sich in den B-Zellen der Langerhansschen Inseln. Insulinsekretion erfolgt durch Exocytose. Die Membranen werden vermutlich durch Endocytose zurückgeführt.
Tab. 1. Insulin. Wirkungen von Insulin auf die Phosphorylierung und die Aktivität verschiedener Enzyme und Proteine. Die Wirkungen sind indirekter Art, d. h. Insulin bindet an seinen Rezeptor auf der Zellmembran und initiiert eine Kette von Ereignissen, die in der Phosphorylierung (Kinasereaktion) oder Dephosphorylierung (Phosphataseaktivität) des Enzyms ihren Höhepunkt erreichen.
| |||
| Fructose-6-phosphat-2-Kinase | ↑ | ↓ | |
| Glycogen-Synthase | ↑ | ↓ | |
| Phosphorylase | ↓ | ↓ | |
| Phosphorylase-Kinase | ↓ | ↓ | |
| Phosphoprotein-Phosphatase-Inhibitor 1 | ↓ | ↓ | |
| Pyruvat-Dehydrogenase | ↑ | ↓ | |
| Pyruvat-Kinase | ↑ | ↓ | |
| Enzyme des Lipidstoffwechsels | |||
| Acetyl-CoA-Carboxylase | ↑ | ↑ | |
| ATP-Citrat-Lyase | keine Änderung | ↑ | |
| Diacylglycerin-Acyltransferase | ↑ | ↓ | |
| Glycerinphosphat-Acyltransferase | ↑ | ↓ | |
| Hydroxymethylglutaryl-CoA-Reduktase | ↑ | ↓ | |
| Hydroxymethylglutaryl-CoA-Reduktase-Kinase | ↓ | ↓ | |
| Triacylglycerin-Lipase | ↓ | ↓ | |
| Andere | |||
| Insulinrezeptor (β-Untereinheit) | ? | ↑ | |
| Ribosomales Protein S6 (in 40S-Untereinheit) | ? | ↑ | |
| zyklisches-AMP-Phosphodiesterase (niedriger Km -Typ) | ↑ | ↑ | |
| Ca-ATPase der Plasmamembran | ↓ | ↓? | |
| Na/K-ATPase der Plasmamembran | ↑? | ↑ |
↑ = Phosphorylierung bzw. Aktivitätszunahme;
↓ = Dephosphorylierung bzw. Aktivitätsabnahme
Tab. 2. Insulin. Wirkungen von Insulin und anderen Hormonen auf den Kohlenhydrat- und Lipidstoffwechsel im Muskel, im Fettgewebe und in der Leber. Insulin stimuliert in allen drei Geweben die Aminosäureaufnahme und die Proteinsynthese.
| |||||
| Muskel | Glucoseaufnahme | ↑ | ↑ | ↑ | |
| Glycolyse | ↑ | ↑ | ↑ | ||
| Glycogenolyse | ↓ | ↑ | ↑ | ||
| Glycogensynthese | ↑ | ↓ | ↑ | ||
| Fettgewebe | Glucoseaufnahme | ↑ | ↓ | (↓) | |
| Lipogenese | ↑ | ↓ | (↓) | ||
| Lipolyse | ↓ | ↑ | (↑) | ||
| Leber | Fettsäuresynthese | ↑ | ↓ | ↓ | |
| Fettsäureoxidation | ↓ | ↑ | ↑ | ||
| Gluconeogenese | ↓ | (-) | ↑ | ||
| Glycogenolyse | ↓ | ↑ | ↑ | ||
| Glycogensynthese | ↑ | ↓ | ↓ | ||
| Ketonkörperbildung | ↓ | (-) | ↑ |
↑ = Aktivitätszunahme; ↓ = Aktivitätsabnahme
Schreiben Sie uns!