Lexikon der Biochemie: Insulinrezeptor
Insulinrezeptor, ein tetrameres Transmembran-Glycoprotein, das nach Bindung von Insulin durch Autophosphorylierung eines Tyrosinrests das extrazelluläre Signal in die Zelle weiterleitet. Es besteht aus zwei α- und zwei β-Untereinheiten, die durch Disulfidbindungen verknüpft sind. Diese heterotetramere Form stammt von einer einzelnen Polypeptidvorstufe ab (Abb. 1), deren Struktur von einem cDNA-Klon hergeleitet wurde. Im endoplasmatischen Reticulum erfolgt die Abspaltung der Signalsequenz, die partielle Glycosylierung, die Faltung des Polypeptids und die Bildung der Disulfidbindungen, die die α- und β-Untereinheiten verknüpfen. Die weitere Glycosylierung und die proteolytische Spaltung in α- und β-Untereinheiten werden im Golgi-Apparat durchgeführt. Anschließend erfolgt der Transport zur Plasmamembran.
Die kurzzeitigen metabolischen Wirkungen und die langzeitige wachstumsfördernde Aktivität von Insulin werden durch dessen Bindung an den spezifischen Zelloberflächenrezeptor mit hoher Affinität angeregt. Die Bindungsanalyse von 125I-markiertem Insulin an den I. ergibt ein gebogenes Scatchard-Diagramm und eine Bindungskonstante von 1nM. Bei der milden reduktiven Spaltung (Dithiothreitol) des in Triton X-100 gelösten, affinitätsmarkierten I. (Mr 440 kDa) entstehen durch Spaltung der Disulfidbindungen zwischen den α-Untereinheiten zwei identische Dimere (Mr 220 kDa). Bei der vollständigen Reduktion bilden sich getrennte α- und β-Untereinheiten (Mr 120 und 90 kDa), wobei die α-Untereinheiten eine hohe 125I-Insulinaktivität aufweisen. Folglich bindet jede α-Untereinheit auf der äußeren Membranoberfläche ein Insulinmolekül. Nur die β-Untereinheiten durchspannen die Membran (Abb. 2). Die Insulinbindung ruft eine Tyrosin-Kinase-Aktivität (gedeutet als starke Zunahme von Vmax eines existierenden aktiven Zentrums) in der intrazellulären Domäne der β-Untereinheit hervor. Die insulinabhängige Kinase katalysiert die Phosphorylierung von Tyr-Resten in der β-Untereinheit selbst und auch von anderen Peptiden und Proteinen (Protein-Tyrosin-Kinase, Rezeptor-Tyrosin-Kinasen) durch ATP. Auch Serinreste des I. werden phosphoryliert, jedoch befindet sich die verantwortliche Serin-Kinase nicht im I.
Zwischen der β-Untereinheit des I., den Rezeptoren anderer Wachstumsfaktoren (z. B. Epidermis-Wachstumsfaktor-Rezeptor) und bestimmter Onkogenprodukte, die Tyrosin-Kinase-Aktivität besitzen (z. B. Produkte der src-Genfamilie) bestehen viele Ähnlichkeiten. [M.P.Czech Recent Progress in Hormone Research 40 (1984) 347-377; A. Ullrich et al. Nature313 (1985) 756-761]
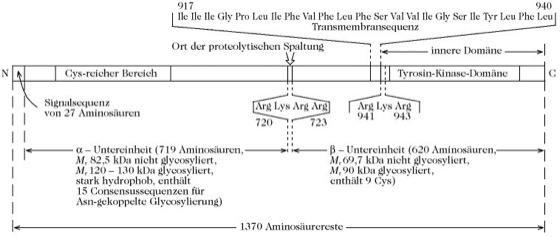
Abb. 1. Insulinrezeptor. Struktur des Vorstufenpolypeptids des Insulinrezeptors. Eine Sequenz basischer Aminosäuren (in diesem Fall Arg941, Lys942, Arg943) an der Verbindungsstelle zwischen der Transmembransequenz und der Cytoplasmadomäne ist ein allgemeines Merkmal von Transmembranproteinen. Man nimmt an, dass sie mit den polaren Gruppen von Phospholipiden auf der Membranoberfläche in Wechselwirkung treten.
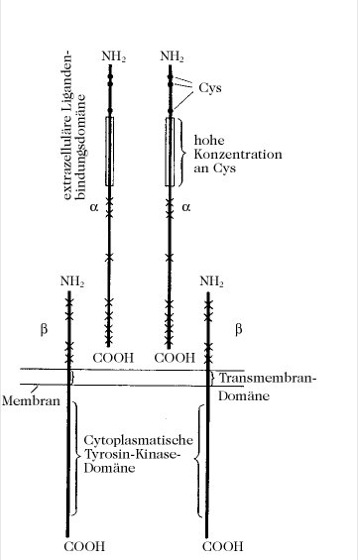
Abb. 2. Insulinrezeptor. Vorgeschlagene Anordnung des heterotetrameren Insulinrezeptorkomplexes. Einzelne Cys-Reste, die an Disulfidbindungen zwischen den Einheiten beteiligt sein können, sind durch X gekennzeichnet.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.