Lexikon der Biochemie: L-Lysin
L-Lysin, Lys, α,ε-Diaminocapronsäure, 2,6-Diaminocapronsäure, H2N-(CH2)4-CH(NH2)-COOH, eine basische proteinogene essenzielle Aminosäure. Mr 146,2Da, F. 224°C (Z.), [α] ![]()
+25,9° (c = 2 in 5M Salzsäure) bzw. +13,5° (c = 2, Wasser). Lys ist in Proteinen aus Getreide (Weizen, Gerste, Reis) und in anderen pflanzlichen Nahrungsmitteln in begrenzter Menge vorhanden. Der Bedarf an Lys ist besonders für das Kind und das junge wachsende Tier hoch, da es speziell für die Knochenbildung wichtig ist. Wie Threonin ist Lys nicht an reversiblen Transaminierungen beteiligt.
In der Rattenleber wird Lys hauptsächlich in den Mitochondrien abgebaut (Abb. 1). Dass er eine Umkehr der Reaktionen der Lys-Synthese darstellt (Abb. 2), ist eine Besonderheit dieses Abbauwegs. Die Bildung von Saccharopin eröffnet einen direkten Zugang zu 2-Aminoadipin-6-semialdehyd unter Umgehung der zyklischen Piperidein- und Piperidinintermediate. Der Semialdehyd wird auch auf einem zweiten Weg produziert, der durch die L-Aminosäure-Oxidase eingeleitet wird. Die gebildete Oxosäure zyklisiert spontan zu Δ1-Piperidein-2-carbonsäure. Der Semialdehyd wird anschließend zu 2-Aminoadipinsäure oxidiert, die zu 2-Oxoadipinsäure transaminiert wird. Der weitere Abbau über Glutaryl-CoA zu Acetyl-CoA ist mit den letzten Schritten des L-Tryptophanabbaus (L-Tryptophan) identisch. An einem alternativen Weg des Lysinabbaus in Säugetieren (und in Hefen) sind acetylierte Intermediate beteiligt, wodurch eine Zyklisierung verhindert wird. Ein weiterer Weg existiert in Bakterien. D-Lysin kann diesen Weg durch Umwandlung in L-Lysin mit Hilfe einer Pyridoxalphosphat-abhängigen Racemase ebenfalls beschreiten. Lys wird durch L-Lysin-Oxygenase in 5-Aminovaleramid überführt.
Für die Biosynthese von Lys gibt es in Pflanzen und Mikroorganismen zwei Wege: 1) Im α-Aminoadipinsäureweg in Brotschimmel (Neurospora crassa), der Bäckerhefe (Saccharomyces cerevisiae)u.a. wird Lys über α-Aminoadipinsäure aufgebaut. Diese Reaktionsfolge ist homolog zum Tricarbonsäure-Zyklus bis zur Stufe der α-Ketoadipinsäure. 2) Der Diaminopimelinsäureweg (Abb. 2), der in Bakterien, Blaualgen, Grünalgen, höheren Pflanzen und bestimmten Pilzen abläuft, enthält als Schlüsselsubstanz die L-α,ε-Diaminopimelinsäure, die nach Umsetzung zur meso-α,ε-Diaminopimelinsäure durch Decarboxylierung in Lys umgewandelt wird.
Von besonderer technischer Bedeutung ist die enzymatische Synthese von Lys aus DL-α-Aminocaprolactam mit Hilfe der mikrobiell zugänglichen L-Aminocaprolactam-Hydrolase. Das bei der Synthese anfallende D-α-Aminocaprolactam wird enzymatisch racemisiert und schließlich vollständig in Lys überführt. Verwendet wird Lys als Futtermittelzusatz sowie zur Aufwertung biologisch minderwertiger pflanzlicher Nahrungsproteine. Durch einen Zusatz von 0,1-0,3% Lys kann die Wachstumsrate von Geflügel und Schweinen beträchtlich gesteigert werden. Lys wurde 1889 von Drechsel erstmals aus Casein isoliert.

L-Lysin. Abb. 1. Abbau von L-Lysin in der Tierleber.
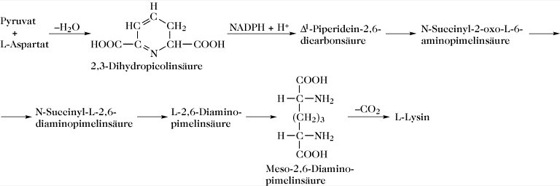
L-Lysin. Abb. 2. Diaminopimelinsäureweg der L-Lysin-Biosynthese.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.