Lexikon der Biochemie: L-Tryptophan
L-Tryptophan, Trp, α-Amino-β-indolylpropionsäure, eine aromatische, essenzielle Aminosäure. Mr 204,2Da, F. 281-282°C, [α] ![]()
-33,7° (c = 1-2, Wasser) oder +2,8° (c = 1-2 in 1M Salzsäure). L-T. tritt in Proteinen in relativ geringer Menge auf, ist aber trotzdem ernährungsphysiologisch sehr wichtig. Bei saurer Proteinhydrolyse wird L-T. vollständig zerstört. Mit p-Dimethylaminobenzaldehyd oder Xanthydrol ergibt L-T. eine violette Färbung, die zu seiner Bestimmung ausgenutzt wird.
L-T. bildet etliche stoffwechselphysiologisch wichtige Metabolite. Durch Öffnung des Pyrrolrings von L-T. und Oxidation (Tryptophan-2,3-Dioxygenase) wird N-Formylkynurenin gebildet. Dies ist in der tierischen Leber der erste Reaktionsschritt im Hauptstoffwechselweg von T. (Abb. 1). Das offenkettige Intermediat 2-Amino-3-carboxymuconsäuresemialdehyd (IX, Abb. 1) dient als Ausgangspunkt für zwei unterschiedliche Pfade. Durch spontane Zyklisierung von IX entsteht Chinolinsäure, die Vorstufe des Nicotinsäureamid-Molekülteils von NAD. Dagegen initiiert die enzymatische Umwandlung von IX in 2-Aminomuconsäure (X, Abb. 1) den Weg zum vollständigen Abbau zu CO2 und H2O über Acetyl-CoA und den Tricarbonsäure-Zyklus. Inwieweit die spontane Zyklisierung von IX zur NAD-Synthese ausgenutzt werden kann, hängt davon ab, in welchem Verhältnis die Geschwindigkeit der Bildung von IX aus VI zur Umsetzung in X steht. Für Ratten beispielsweise ist Nicotinsäure kein essenzieller Nahrungsbestandteil (d.h. es ist kein Vitamin), da der gesamte Bedarf an NAD und NADP durch Synthese aus T. gedeckt werden kann. Bei Katzen erfolgt dagegen keine NAD-Synthese aus T. und Nicotinsäure muss vollständig mit der Nahrung aufgenommen werden. Bei Menschen wird ein Teil des NAD aus T. synthetisiert, die Zyklisierungsgeschwindigkeit von IX ist jedoch nicht hoch genug um den gesamten NAD-Bedarf zu decken, der Rest muss aus Nicotinsäure bzw. Nicotinsäureamid aus der Nahrung gedeckt werden.
Der T.-Abbau wird durch Vitamin-B6-Mangel stark beeinträchtigt. Die Kynureninase, die die Spaltung von 3-Hydroxykynurenin in 3-Hydroxyanthranilsäure und L-Alanin katalysiert, ist ein Pyridoxalphosphat-abhängiges Enzym. Bei Vitamin-B6-Mangel nimmt die Aktivität der Leber-Kynureninase (EC 3.7.1.3) viel stärker ab als die anderer Pyridoxalphosphat-abhängiger Enzyme. Als Folge werden Verbindungen des T.-Abbauwegs, die vor der Hydrolyse von 3-Hydroxykynurenin vorkommen, in größeren Mengen ausgeschieden (z.B. Xanthurensäure und Kynureninsäure), während der Urinspiegel an Nicotinsäurederivaten erniedrigt ist.
Folgende T.-Metabolite werden unter separaten Stichworteinträgen beschrieben: Actinomycine, Indican, Indigo, Indolalkaloide, Krötengifte, L-Kynurenin, Melatonin, Ommochrome, Phallotoxine, Serotonin, Tryptamin und Violacein. Der Status des Auxins als T.-Metabolit ist in Frage gestellt.
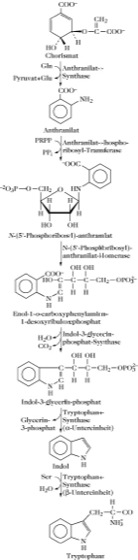
Bei Bakterien und Pflanzen wird T. über den Shikimisäure-Chorisminsäure-Weg der Aromatenbiosynthese gebildet (Abb. 2; Tryptophan-Synthase). Chorisminsäure wird zu Anthranilsäure umgesetzt, die über verschiedene Zwischenstufen in T. überführt wird (Abb. 2). Anthranilsäure und L-T. sind Vorstufen in der Biosynthese von Alkaloiden, z.B. der Mutterkorn-Alkaloide, wo L-T. möglicherweise als Induktor wirkt.
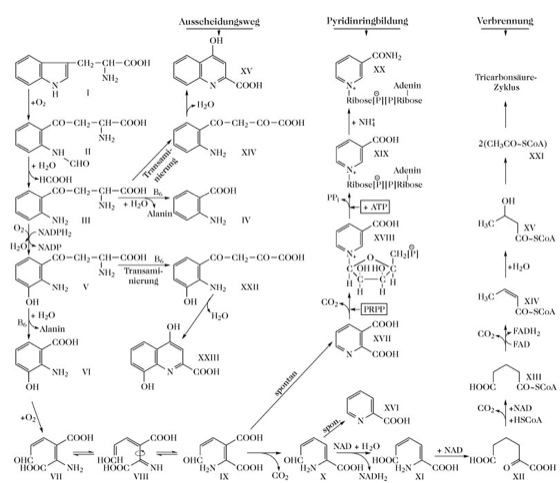
L-Tryptophan. Abb. 1. Stoffwechselwege des L-Tryptophans, eingeleitet durch Bildung von N-Formylkynurenin in tierischer Leber. PRPP = 5-Phosphoribosyl-1-pyrophosphat. I L-Tryptophan, II N-Formylkynurenin, III Kynurenin, IV Anthranilsäure, V 3-Hydroxykynurenin, VI 3-Hydroxyanthranilsäure, VII, VIII, IX 2-Amino-3-carboxymuconsäuresemialdehyd, X 2-Aminomuconsäuresemialdehyd, XI 2-Aminomuconsäure, XII 2-Oxoadipinsäure, XIII Glutaryl-CoA, XIV Crotonyl-CoA, XV 3-Hydroxybuturyl-CoA, XVI Picolinsäure, XVII Chinolinsäure, XVIII Nicotinsäuremononucleotid, XIX Desamino-NAD, XX NAD, XXI Acetyl-CoA, XXIIo-Amino-m-hydroxybenzoylpyruvinsäure, XXIII Xanthurensäure, XXIVo-Aminobenzoylpyruvinsäure, XXV Kynureninsäure.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.