Lexikon der Biochemie: Oxidation
Oxidation, die Abgabe von Elektronen, früher die Vereinigung mit Sauerstoff oder der Entzug von Wasserstoff (sauerstofflose O.). Da das Oxidationsmittel die Elektronen aufnimmt, sind O. und Reduktion durch Elektronenübergänge gekoppelte Vorgänge, nämlich Oxidoreduktionen. Im Stoffwechsel müssen die durch unterschiedliche Typen von Oxidationsenzymen katalysierten Prozesse der Dehydrierung, der Elektronenübertragung, der Einführung von Sauerstoff in organische Verbindungen und der Hydroxylierung unterschieden werden (Tab.).
Oxidations- bzw. Reduktionsmittel lassen sich nach Vorzeichen und Stärke ihres Redoxpotenzials in einer Redoxkette anordnen. Das Redoxpotenzial, das auf das Wasserstoffhalbelement bezogen wird, ist ein quantitatives Maß für die Elektronenaffinität (d.h. Oxidationskraft) bzw. die Tendenz der Glieder der Redoxkette, Elektronen abzugeben (d.h. Reduktionskraft). Das physiko-chemisch definierte Standardpotenzial bzw. Normalpotenzial E0 (pH 0, pH2 ≈ 0,1MPa) ist allerdings für biologische Zwecke nicht geeignet. Man wählt als Bezugspunkt das Normalpotenzial E0'bei pH 7,0. E0' hat gegenüber dem E0 eine Potenzialdifferenz von -0,42Volt. Der Wert von E0' gilt aber nur unter Standardreaktionsbedingungen, nämlich bei Einheitskonzentrationen bzw. den Aktivitäten 1 der Reaktionsteilnehmer. Diese sind unter physiologischen Verhältnissen nicht gegeben, da das Konzentrationsverhältnis der oxidierten und reduzierten Stufe eines Redoxpaares in die Rechnung eingeht. Das aktuelle Redoxpotenzial E' wird deshalb ausgedrückt durch: E' = E'0+ (0,06/n) log Ox/Red (30 °C). Das Redoxpotenzial ist mit der freien Enthalpie (Gibbssches Potenzial) ΔG0 wie folgt verknüpft:
ΔG0= -nFE0. Hierbei bedeuten n den Valenzwechsel und F die Faraday-Konstante. Eine Anordnung von Redoxpaaren nach steigenden E'0-Werten zu einer Redoxskala wird auch bei der Formulierung der Reihenfolge der Glieder der Atmungskette (Tab. 1) vorgenommen. Je höher der Wert von E'0, um so stärker oxidierend wirkt ein Stoff bzw. Redoxpaar: Das System mit dem positiveren (höheren) E' 0oxidiert ein System mit einem negativeren E'0.
Oxidation. Oxidationsreaktionen im Stoffwechsel.
| |||
| Dehydrierung | Oxidoreduktasen (Dehydrogenasen) | ||
| Elektronenübertragung | 4- und 2-elektronenübertragende Oxidasen | 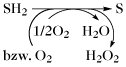 | |
| Sauerstoffübertragung | Dioxygenasen | S + O2 → SO2 | |
| Hydroxylierung | Hydroxylasen (Monooxygenasen) | S + CH2 + O2 → SOH + C + H2O |
S = Substrat, C = Wasserstoff-tragender Cofaktor.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.