Lexikon der Biochemie: Papierchromatographie
Papierchromatographie, schichtchromatographische Methode zur Trennung kleiner Substanzmengen. Die P. ist eine Verteilungschromatographie; als stationäre Phase dient der auf Filtrierpapierstreifen befindliche Wasserfilm, als mobile Phase verwendet man organische Lösungsmittel bzw. deren Gemische (Lauf- oder Fließmittel). Als Laufmittel dienen gereinigte organische Lösungsmittel, die unbegrenzt oder begrenzt mit Wasser mischbar sind, sowie spezielle Pufferlösungen. Als Standardlaufmittelgemische werden Butanol/Eisessig/Wasser, Phenol/Wasser oder Pyridin/Butanol/Wasser eingesetzt. Für ein zu trennendes Substanzgemisch ist das Laufmittel am geeignetsten, das eine möglichst weit auseinanderliegende Lage der einzelnen Substanzflecke ergibt. Die Chromatographiepapiere bestehen aus Baumwollcellulose.
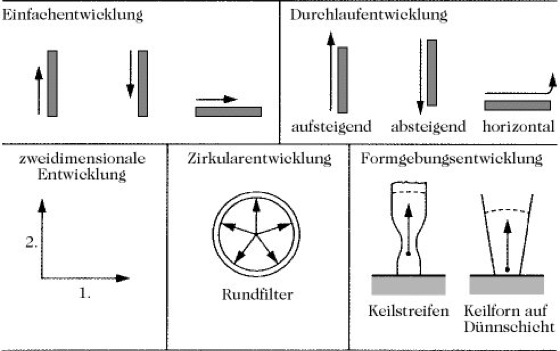
Die Entwicklung der Chromatogramme erfolgt in geschlossenen Gefäßen, die mit Lösungsmitteldämpfen gesättigt sind und einen konstanten Wassergehalt des Papiers garantieren. Die zu trennenden Substanzmengen liegen im Bereich von 5-50 mg und werden in 0,1-1%igen wässrigen Lösungen oder im Laufmittel gelöst auf einer Startlinie dosiert. Der Durchmesser des Startflecks soll nicht größer als 0,5mm sein. Nach einer längeren Laufzeit (30 Min.-3Std.) erhält man Substanzflecke, die in unterschiedlicher Entfernung von der Startlinie sichtbar sind oder sichtbar gemacht werden können. Je nach Richtung des Laufmittels unterscheidet man aufsteigende, absteigende und horizontale P. (Abb.).
Bei der horizontalen P. fließt das Laufmittel unter Einwirkung der Papierkapillarität in der Papierebene. Diese Entwicklungsart wird vorwiegend als Rundfilter- oder Zirkularmethode betrieben. Eine Modifizierung der Rundfiltermethode ist die Formgebungsentwicklung, bei der Keilstreifen nach der aufsteigenden Methode entwickelt werden. Durch Kombination geeigneter Laufmittel sowie Stufen-, Mehrfach- oder zweidimensionale Entwicklung lassen sich wesentliche Verbesserungen von Trennungen erzielen.
Zur Trennung lipophiler Stoffe eignet sich die Umkehrphasen-Chromatograpie. Der Nachweis der getrennten Verbindungen erfolgt durch ihre Eigenfarbe, farblose Substanzen werden durch Aufsprühen geeigneter Reagenzien sichtbar gemacht. Die Lokalisierung der getrennten Komponenten kann auch durch Betrachtung im UV-Licht erfolgen (Fluoreszenz oder Fluoreszenzlöschung).
Grundlage der qualitativen Auswertung sind die unterschiedlichen Wanderungsgeschwindigkeiten der Verbindungen in bestimmten Laufmitteln. Zur Bezeichnung der Lage einer Substanz auf dem Chromatogramm verwendet man den RF-Wert (engl. retention value factor, auch ratio to the front) als den Quotienten aus der Entfernung des Substanzflecks vom Startpunkt und der Entfernung zwischen Laufmittelfront und Startpunkt. Zur Vereinfachung und Vereinheitlichung gibt man heute meist hRF-Werte an (= RF·100). Bei fehlender Lösungsmittelfront (Durchlaufchromatogramm) lässt man eine Vergleichssubstanz X mitlaufen. Der Quotient aus der Laufstrecke der unbekannten Substanz und der Vergleichssubstanz wird als Rx-Wert (oder auch als RSt-Wert: engl. ratio standard) bezeichnet.
Zur quantitativen Auswertung bedient man sich der Beziehung zwischen Fleckgröße und Konzentration. Sie erfolgt durch Vergleich auf dem Papier, photometrisch sowie nach Extraktion der Flecke durch Extinktionsmessung.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.