Lexikon der Biochemie: Pyrimidinbiosynthese
Pyrimidinbiosynthese,de-novo-Pyrimidinsynthese, die Neubildung des Pyrimidinrings von Uracil, Thymin, Cytosin und deren Derivaten aus Carbamylphosphat und Aspartat (Ausnahme ist der Pyrimidinring des Thiamins in allen lebenden Zellen).
Biosynthese von Uridin- und Cytidinnucleotiden. Die P. führt über Orotsäure, die Muttersubstanz der Pyrimidine, durch mehrere enzymatisch katalysierte Reaktionen zu Pyrimidinnucleotiden (Abb. 1). Als erstes Pyrimidinnucleotid wird de novo Uridin-5'-monophosphat (UMP, Uridylsäure) gebildet, dessen weitere enzymatische Umsetzung Uridin-5'-triphosphat (UTP) liefert. Aus UTP entsteht Cytidin-5'-triphosphat (CTP), wobei Ammoniak oder – besonders in tierischen Geweben – Glutamin als Aminogruppendonator dient.
Biosynthese von Thymidinnucleotiden. Da Thymidin Baustein der DNA ist, enthält das korrespondierende Nucleotid 2-Desoxyribose. Die de-novo-Synthese des DNA-Bausteins Thymidin-5'-monophosphat (TMP, Thymidylsäure; exakter: Desoxythymidin-5'-monophosphat, dTMP, Desoxythymidylsäure) erfolgt durch die Reaktionssequenz:
CMP → CDP → dCDP → dCMP → dUMP → TMP (dTMP) → TDP (dTDP) → TTP (dTTP; Abb. 2).
Die Methylierung von dUMP zu TMP wird durch die Thymidylat-Synthase (EC 2.1.1.45) katalysiert. Der Cofaktor N5,N10-Methylentetrahydrofolsäure überträgt die aktive C-1-Einheit auf C5 von dUMP und fungiert auch als reduzierendes Agens zur de-novo-Bildung der Methylgruppe aus der aktiven C-1-Einheit.
Biosynthese von Ribothymidylsäure. Die Verbindung kommt als seltener Nucleinsäurebaustein in vielen spezifischen tRNA-Arten vor. Sie wird durch Methylierung (mit S-Adenosyl-L-methionin) des C5 von Uracil im bestehenden Nucleinsäuremolekül gebildet.
Pyrimidinnucleotide können auch über den Wiederverwertungsweg gebildet werden.
Regulation der P. Die carbamylphosphatsynthetisierenden Enzyme unterliegen einer differenzierten Kontrolle. Im Bakterium Escherichia coli wird die Carbamylphosphat-Synthetase durch die Purinnucleotide IMP und XMP aktiviert und durch die Pyrimidinnucleotide UMP und UDP gehemmt. Der Schlüsselregelpunkt ist die Synthese von N-Carbamylaspartat, katalysiert durch die Aspartatcarbamyl-Transferase (Aspartat-Transcarbamylase, EC 2.1.3.2). In E. coli und Aerobacter aerogenes wird dieses Enzym durch CTP inhibiert und durch ATP eine Inhibierung verhindert. In Pseudomonas fluorescens erfolgt eine Inhibierung des Enzyms durch UTP, während in höheren Pflanzen der regulatorische Inhibitor UMP ist.
Die Aspartatcarbamyl-Transferase aus E. coli ist eines der am besten untersuchten allosterischen Enzyme. Es besitzt ein Mr von 310 kDa und kann in zwei identische katalytische Untereinheiten (jeweils Mr 100 kDa, drei Polypeptidketten, die C-Ketten von Mr 34kDa) und drei identische regulatorische Untereinheiten dissoziiert werden. Jede regulatorische Untereinheit enthält zwei R-Ketten (Mr 17kDa); jede R-Kette bindet ein CTP-Molekül. Die katalytischen Untereinheiten sind in Abwesenheit der regulatorischen Untereinheiten aktiv, eine Regulierung durch CTP erfolgt jedoch nur am vollständigen oligomeren Enzym. Der Regulierungsmechanismus wird durch das Kooperativitätsmodell der allosterischen Enyzme erklärt. In einigen Fällen kann auch Uracil die Synthese von Aspartatcarbamyl-Transferase und von Dihydroorotat-Dehydrogenase (EC 1.3.3.1) reprimieren.
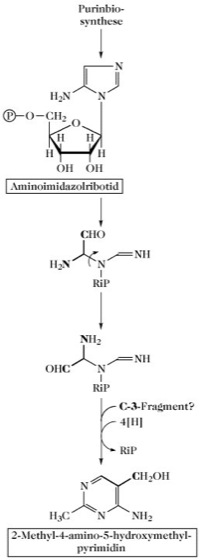
Biosynthese des Pyrimidinrings des Thiamins (Vitamin B1) aus Aminoimidazolribonucleotid. Der Ring wird nicht nach dem o. a. Orotsäureschema der P. synthetisiert, vielmehr entsteht das im Thiamin enthaltene 2-Methyl-4-amino-5-hydroxymethylpyrimidin aus einem Zwischenprodukt der Purinbiosynthese, dem Aminoimidazolribonucleotid (Abb. 3).
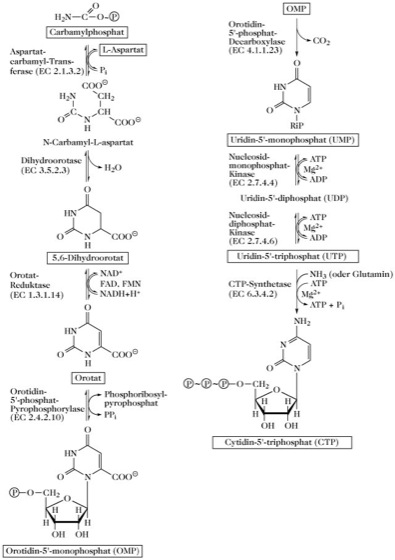
Pyrimidinbiosynthese. Abb. 1. Biosynthese von Uridin- und Cytidinnucleotiden.
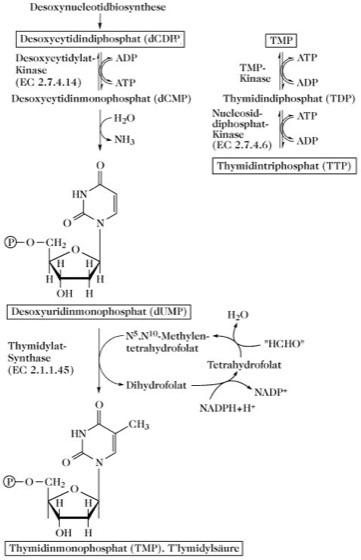
Pyrimidinbiosynthese. Abb. 2. Biosynthese von Thymidinnucleotiden.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.