Lexikon der Biochemie: Transketolase
Transketolase (EC 2.2.1.1), Enzym, das die Transketolierung katalysiert, ein wichtiger Vorgang des Kohlenhydratstoffwechsels, insbesondere im Pentosephosphat-Zyklus und Calvin-Zyklus. Es kommt in verschiedenen Zell- und Gewebearten, wie Säugetierleber, in grünen Pflanzen, und in zahlreichen Bakterienspezies, vor. Das Enzym enthält Thiaminpyrophosphat als Coenzym und divalente Metallkationen. Bei der Transketolierung wird eine C2-Einheit (oft als aktiver Glycolaldehyd bezeichnet) von einer Ketose auf das C1 einer Aldose übertragen. Dabei können nur Ketosen mit L-Konfiguration an C3 und vorzugsweise trans-Konfiguration am folgenden C-Atom (Konfigurationen C1, C2, C3 und bevorzugt C4 entsprechen der von Fructose) als Donator für C2-Einheiten fungieren. Der Akzeptor ist stets eine Aldose. Die Transketolierung verläuft reversibel. In der Abb. wird der Ablauf der Reaktion gezeigt, bei der Xylulose-5-phosphat als Donator der C2-Einheit und Ribose-5-phosphat als Akzeptor dient. Die C2-Einheit wird an Thiaminpyrophosphat gebunden, wobei 2-(α,β-Dihydroxyethyl)-thiaminpyrophosphat entsteht und der verbliebene Molekülteil als Glycerinaldehyd-3-phosphat abgespalten wird. Durch Übertragung der C2-Einheit auf Ribose-5-phosphat wird Sedoheptulose-7-phosphat gebildet. Wenn in die Reaktion an Stelle von Ribose-5-phosphat Erythrose-4-phosphat eingeht, entstehen die Produkte Glycerinaldehyd-3-phosphat und Fructose-6-phosphat.
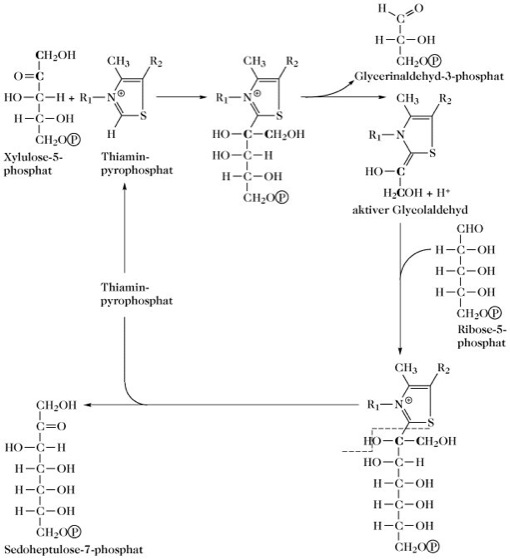
Transketolase. Mechanismus der Transketolase-Reaktion (beim Thiaminpyrophosphat ist nur der Thiazolanteil gezeigt).
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.