Lexikon der Biochemie: Tricarbonsäure-Zyklus
Tricarbonsäure-Zyklus, Citrat-Zyklus, Citronensäure-Zyklus, Krebs-Zyklus, die wichtigste zyklische Reaktionsfolge für den oxidativen Endabbau der Proteine, Fette und Kohlenhydrate zu CO2 und H2O (Abb.1). Im T. entsteht CO2 durch oxidative Decarboxylierung von Oxosäuren (Oxalsuccinat, in Abb. 1 nicht gezeigt, als Intermediat zwischen Isocitrat und α-Ketoglutarat; Isocitrat-Dehydrogenase). In Verbindung mit der Atmungskette erfolgt der Energieumsatz zur Synthese des energiereichen Adenosintriphosphats. Neben dem Energiegewinn spielt der T. eine wichtige Rolle bei der Synthese von neuem zelleigenem Material. Verschiedene wichtige Substanzgruppen stammen von Zwischenprodukten des T. ab und verschiedene Stoffwechselzyklen sind mit dem T. verknüpft. Bei Eukaryonten läuft der T. in den Mitochondrien ab, wo er strukturell und funktionell in die Atmungskette und den Fettsäureabbau einbezogen wird. Bei Prokaryonten sind die Enzyme des T. im Zellcytoplasma lokalisiert.
Die biologische Bedeutung des T. liegt in der Oxidation und Zerlegung der Acetylgruppe von Acetyl-Coenzym A in zwei Moleküle CO2. Dabei entstehen viermal zwei Wasserstoffatome, die auf NAD+ oder FAD übertragen werden. Die Regeneration dieser Coenzyme erfolgt über die Atmungskette, wobei die Wasserstoffatome zu Wasser oxidiert werden.
Die Oxidationen im T. erfolgen durch mehrmalige Wasseranlagerung und anschließende Dehydrierung; Sauerstoff spielt direkt keine Rolle: CH3CO-SCoA + 3H2O → 2CO2+ 8[H] + HSCoA. Inizialreaktion des T. ist die Kondensation des Acetyl-Coenzyms A mit Oxalacetat, die durch die Citrat-Synthase katalysiert wird. Unter Wasseraufnahme entstehen Citrat und freies Coenzym A. Aus dem Citrat wird über sieben weitere, teilweise komplexe Reaktionsschritte (Tab. 1) das Oxalacetat regeneriert. Die Reaktionen 3 und 4 sind mit Decarboxylierungen verbunden(α-Ketoglutarat-Dehydrogenase-Komplex).
Energiebilanz des T.: Bei der Oxidation von Acetyl-CoA im T. werden insgesamt 901,7kJ (215,2kcal) chemische Energie frei, davon 800,29kJ (191kcal) über die Atmungskette. Die über die Atmungskette gewonnene Energie rührt von zwei NADH und einem FADH2 her: NADH + 1/2O2 + H+ → NAD+ + H2O, ΔG0' = -219,4kJ; FADH2 + 1/2O2 → FAD + H2O, ΔG0' = -151,6kJ. Ein Teil dieser Energie wird zur Synthese von 12 Molekülen ATP verwertet, was einer Energieausbeute von etwa 40 % der gesamten freien Energie entspricht: in den Reaktionen 3, 4 und 8 ergeben sich durch NADH-Oxidation in der Atmungskette 3-mal drei Moleküle ATP; in der Reaktion 6 ergeben sich durch FADH2-Oxidation in der Atmungskette zwei Moleküle ATP; und das in der Reaktion 5 (Substratkettenphosphorylierung) gebildete GTP ist energetisch äquivalent mit ATP, d.h. GTP + ADP ![]()
GDP + ATP besitzt eine Gleichgewichtskonstante von 1,0. Bilanz des T. (einschließlich Atmungskette):
CH3CO-SCoA + GDP + 11ADP + 12Pi + 2O2 → 2CO2 + 13H2O + GTP + 11ATP + HSCoA.
Der T. steht über Oxalacetat mit der Gluconeogenese in Verbindung. Er ist ferner Ausgangspunkt für die Synthesen mehrerer Aminosäuren, besonders von Asparaginsäure und Glutaminsäure, und er liefert mit Succinyl-Coenzym A eine Ausgangsverbindung für die Synthese der Porphyrine, z.B. von Hämoglobin, Chlorophyll (Abb. 2) und Vitamin B12. Unter Einbeziehung weiterer Zwischenprodukte kann der T. abgewandelt werden. Solche Nebenwege des T. sind der 4-Aminobuttersäureweg (4-Aminobuttersäure), der Glyoxylat-Zyklus und der Succinat-Glycin-Zyklus. Die Carboxylierung von Pyruvat (Pyruvat-Carboxylase, Carboxylierung) ist ein Schritt in der Gluconeogenese aus Pyruvat. Sie ist aber ebenso eine anaplerotische Reaktion (Stoffwechsel-Zyklus) des T., d.h. sie hält die Oxalacetat-Konzentration aufrecht, die sich durch Entnahme von Zwischenprodukten des T. für Biosynthesen sonst erschöpfen würde. Bei Tieren ist die Nettosynthese von Kohlenhydraten aus Acetyl-CoA (und damit aus Fettsäuren) nicht möglich. Bei Pflanzen und Tieren erlaubt das Vorhandensein des Glyoxylat-Zyklus die Inkorporation einer zweiten Acetylgruppe aus Acetyl-CoA, so dass eine Nettosynthese von T.-Zwischenprodukten (und damit von Kohlenhydraten) aus Zwei-Kohlenstoffeinheiten möglich ist. Dies ist wichtig in Samen für die Verwertung von Ölspeicherstoffen zur Synthese von Kohlenhydraten (z.B. Cellulose der Zellwand) während der Keimung sowie für das Wachstum von Bakterien auf Kosten einfacher Kohlenstoffquellen, wie z.B. Acetat.
Reaktionen, die denen des T. analog sind, werden in der Biosynthese von Leucin und Lysin gefunden. In ähnlicher Weise, finden sich Reaktionssequenzen wie die Dehydrierung von Succinat durch ein Flavoenzym, die anschließende Hydration von Fumarat zu Malat und die darauf folgende Dehydrierung von Malat durch eine NAD-abhängige Dehydrogenase bei de" Inizialschritten des Fettsäureabbaus wieder.
Regulation des T. ADP/ATP und NAD+/NADH + H+ wirken als Effektoren des T., wobei besonders die Regulation der Isocitrat-Dehydrogenase, eines allosterischen Proteins, von Bedeutung ist. Das Enzym benötigt ADP als Aktivator. ATP und NADH wirken als Hemmstoffe (Tab. 2). Weitere Angriffspunkte einer Regulation sind die Acetyl-Coenzym-A-, Oxalacetat- und Citratsynthese. Oxalacetat fungiert als Katalysator bei der Oxidation von Acetyl-CoA zu CO2. Oxalacetat wirkt als Hemmstoff der Succinat-Dehydrogenase und der Malat-Dehydrogenase. Da der T. nur in Verbindung mit der Atmungskette abläuft, wird seine Intensität auch vom Sauerstoffangebot reguliert. Unter Anaerobiose kommt es bei Bildung der reduzierten Coenzyme NADH und FADH2 zum Stillstand des T.
Asymmetrischer Citratstoffwechsel. Obwohl das Citratmolekül eine perfekte Bilateralsymmetrie besitzt, wird es asymmetrisch abgebaut (Prochiralität). Entsprechend der von Hirschmann vorgeschlagenen stereochemischen Nummerierung ist C1 am Kettenende und belegt die S-Position (Abb. 3). Citrat, das im T. aus Oxalacetat und [1-14C]-Acetyl-CoA synthetisiert wird, enthält 14C in Position 1 und wird als sn-[1-14C]Citrat bezeichnet. Die Aconitase katalysiert die Abspaltung der OH-Gruppe von C3 und des HR-Protons von C4. Nach der Rückhydratation von cis-Aconitat (Aconitat-Hydratase, Aconitsäure) trägt das gebildete Isocitrat die OH-Gruppe an dem ursprünglichen C4-Atom des Citrats. Das CO2, das bei der Umwandlung von Isocitrat in α-Ketoglutarat gebildet wird, stammt deshalb vom ursprünglichen Oxalacetat und nicht von der Acetylgruppe des Acetyl-CoA ab. Bei der nachfolgenden Decarboxylierung von Succinyl-CoA wird ein weiterer Kohlenstoff des ursprünglichen Oxalacetats abgespalten. Aus diesem Grund enthält das neue katalytische Oxalacetatmolekül, das nach Durchlaufen einer Runde des T. gebildet wird, nur zwei Kohlenstoffatome des ursprünglichen Oxalacetats sowie zwei Kohlenstoffatome der ursprünglichen Acetylgruppe. Da Fumarat und Succinat symmetrisch metabolisiert werden, wird das ursprüngliche Acetyl-C1-Atom gleichmäßig zwischen C1 und C4 und das ursprüngliche Acetyl-C2 zwischen C2 und C3 des neuen Oxalacetats verteilt. In der nächsten Zyklusrunde werden alle C1 als CO2 abgespalten. Das C2 der ursprünglichen Acetylgruppe wird zwischen allen vier Kohlenstoffatomen des neuen Oxalacetats verteilt, so dass es theoretisch durch Decarboxylierung im T. nie vollständig entfernt werden kann. Es taucht erst in der dritten Zyklusrunde in Form von CO2 auf. Die Markierungsmuster, die sich aus der Inkorporation von 14C-markiertem Acetyl-CoA ergeben, sind deshalb komplex. Die grundlegende experimentelle Beobachtung ist jedoch, dass ein Teil des aus markiertem Acetyl-CoA stammenden 14C von Zwischenprodukten des T. zurückgehalten wird.
Geschichtliches. Der T. wurde 1937 etwa gleichzeitig von Krebs und von Martius und Knoop entdeckt. Das gesamte Enzymsystem des T. und der Atmungskette wurde von Green als Multienzymkomplex aufgefasst und als Cyclophorase bezeichnet.
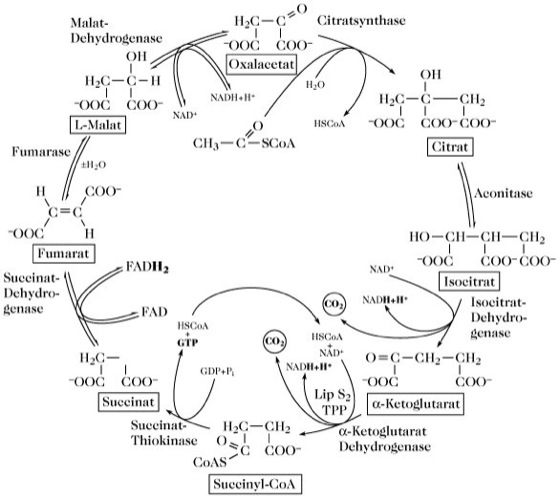
Tricarbonsäure-Zyklus. Abb. 1. Der Tricarbonsäure-Zyklus.
Tricarbonsäure-Zyklus. Tab. 1. Die Reaktionen des Tricarbonsäure-Zyklus.
| |||||
| 1 | Acetyl-CoA + Oxalacetat + H2O → Citrat + HSCoA + H+ | Citrat-(si)-Synthase, (EC 4.1.3.7) | keine | -38,04 (-9,08) | |
| 2a | Citrat Isocitrat | Aconitat-Hydratase (EC 4.2.1.3) | Fluorcitrat* trans-Aconitat* | +6,66 (+1,59) | |
| 2b | Citrat cis-Aconitat | Aconitase | trans- Aconitat* | +8,45 (+2,04) | |
| 2c | cis-Aconitat Isocitrat | Aconitase | trans- Aconitat* | -1,89 (-0,45) | |
| 3 | Isocitrat + NAD+ α-Ketoglutarat + NADH + H+ + CO2 | Isocitrat-Dehydrogenase (EC 1.1.1.41) | ATP | -7,12 (-1,70) | |
| 4 | α-Ketoglutarat + HSCoA + NAD+ Succinyl-CoA + CO2 + NADH + H+ | α-Ketoglutarat-Dehydrogenase-Komplex (EC 1.2.4.2) | Arsenit, Parapyruvat* | -36,95 (-8,82) | |
| 5 | Succinyl-CoA + GDP + Pi Succinat + GTP + HSCoA | Succinyl-CoA-Synthetase (EC 6.2.1.4) | Hydroxylamin | -8,85 (-2,12) | |
| 6 | Succinat + FAD Fumarat + FADH2 | Succinat-Dehydrogenase (EC 1.3.99.1) | Malonat*Oxalacetat* | ~0,0 | |
| 7 | Fumarat + H2O → L-Malat | Fumarat-Dehydratase (EC 4.2.1.2) | meso-Tartrat* | -3,68 (-0,88) | |
| 8 | L-Malat + NAD+ → Oxalacetat + NADH + H+ | Malat-Dehydrogenase (EC 1.1.1.37) | Oxalacetat* Fluormalat* | +28,02 (+6,69) | |
| 1 bis 8: Bilanz des Tricarbonsäure-Zyklus (ohne Atmungskette): Acetyl-CoA + 3NAD+ + FAD + GDP + Pi + 2H2O → 2CO2 + HSCoA + 3NADH + 3H+ + FADH2 + GTP | -60,00 (-14,32) |
Abk.: HSCoA = Coenzym A; GSH = Glutathion; AM(D)(T)P = Adenosinmono-(di-)(tri-)phosphat; TPP = Thiaminpyrophosphat; LipS2 = Liponsäureamid; GD(T)P = Guanosindi-(tri-)phosphat; Pi = anorganisches Phosphat; FAD(H2) = enzymgebundenes oxidiertes (reduziertes) Flavin-adenin-dinucleotid; NAD+(H) = oxidiertes (reduziertes) Nicotinamid-adenin-dinucleotid. Die mit * bezeichneten Verbindungen wirken als kompetitive Inhibitoren.
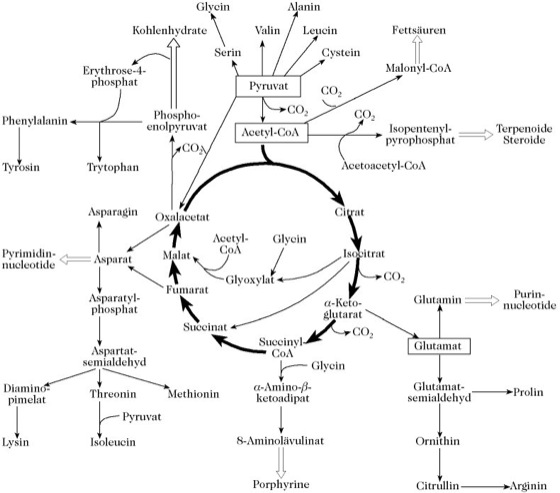
Tricarbonsäure-Zyklus. Abb. 2. Die biosynthetischen Funktionen des Tricarbonsäure-Zyklus.
Tricarbonsäure-Zyklus. Tab. 2. Regulationsmöglichkeiten des Tricarbonsäure-Zyklus.
| |||||||
| Lokalisation | Bedarf an | Freisetzung von | |||||
| 1 | Citrat-Synthase | Mitochon-drien | Acetyl-CoA, Oxal-acetat | Citrat, HSCoA | Langket-tige Acyl-CoA | Kontroll-stelle für Acetyl-CoA-Verbrauch | |
| 3a | NAD-abhängige Isocitrat-Dehydro- genase | Mitochon-drien | NAD+ | NADH, CO2 | ADP | ATP, NADH | niedriger Umsatz des T. |
| 3b | NADP-abhängige Isocitrat-Dehydro- genase | Cytoplasma und Mitochondrien | NADP+ | NADPH, CO2 | Oxal-acetat? | hoher Umsatz des T.; als extramito-chondriales Enzym Bedeutung für NADPH-Bildung | |
| 9 | Glutamat-Dehydro- genase | Mitochondrien | NADPH oder NADH, NH3 | NADP+ oder NAD+ | ADP | GDP + NADH | |
| 10 | Pyruvat-Carboxylase | Cytoplasma | ATP, CO2 | ADP | Acetyl-CoA | Kontrolle des Kohlenhydratstoffwechsels | |
| 11 | Acetyl-CoA- Carboxylase | Cytoplasma | ATP, CO2 | ADP | Citrat | Langket-tige Acyl-CoA | Kontrolle der Fettsyn-these |
| 12 | Citrat-Lyase | Cytoplasma | Citrat | Acetyl-CoA, Oxalacetat | Bedeutung für extramito-chondriale Acetyl-CoA-Synthese | ||
| 13 | Isocitrat-Lyase | Cytoplasma | Isocitrat | Glyoxylat, Dicarbon- säuren | Phosphoenol- pyru-vat | nur in Bakterien und Pflanzen |
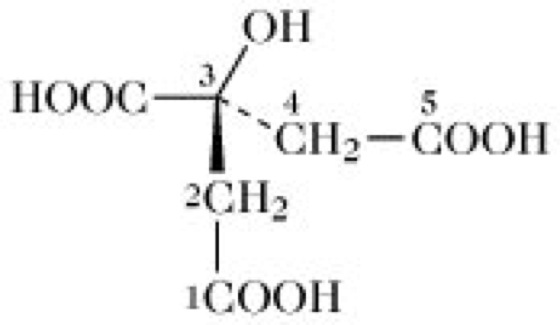
Tricarbonsäure-Zyklus. Abb. 3. Strukturformel des Citrats mit prochiraler Nummerierung der Kohlenstoffatome.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.