Lexikon der Biochemie: Trypsin
Trypsin, EC 3.4.21.4, eine zu den Serin-Proteasen zählende Endopeptidase (Proteasen). Dieses Verdauungsenzym wird von den exokrinen Zellen des Pankreas in Form des enzymatisch inaktiven Zymogens Trypsinogen gebildet, wodurch die exokrinen Zellen vor einer Selbstverdauung geschützt werden. Bei einer verfrühten Aktivierung des vom Pankreas synthetisierten Trypsinogens und anderer pankreatischer Zymogene kann es zu einer akuten Pankreatitis kommen. Nach dem Transport des Trypsinogens in den Dünndarm wird es durch die Enteropeptidase in das aktive T. (Mr 23kDa) umgewandelt, das dann auch autokatalytisch am Aktivierungsprozess teilnimmt. Die Spaltung der Lys15-Ile16-Bindung im Trypsinogen verursacht die Lösung der im Zymogen vorhandenen Asp194-His40-Salzbrücke zugunsten einer neuen Salzbrücke zwischen Asp194 und der neugebildeten N-terminalen Aminosäure Ile16. Im Zuge der ablaufenden Konformationsänderungen wird der Amid-Stickstoff von Gly193 in die Richtung der Substratbindungstasche positioniert, wo dieser als H-Donor für den Substrat-Carbonyl-Sauerstoff im Oxyanion-Loch fungieren kann (s. u.). T. ist ebenfalls in der Lage, andere Zymogene wie z.B. Pro-Elastase, Chymotrypsinogen und Pro-Carboxypeptidase in die entsprechenden aktiven Enzyme umzuwandeln. Der Katalysemechanismus des T. und anderer Serin-Proteasen basiert auf einer katalytischen Triade aus Serin, Histidin und Aspartat, wodurch der Hydroxyl-Sauerstoff des katalytisch aktiven Serins eine außergewöhnliche Reaktivität erhält. Nur das Ser195 der katalytischen Triade lässt sich spezifisch mit organischen Fluorophosphaten, wie z.B. mit Diisopropylfluorophosphat praktisch irreversibel inaktivieren, während die übrigen Serinreste im T. unter diesen Bedingungen überhaupt nicht markiert werden. T. spaltet Peptidbindungen nach Arg/Lys-Resten, wobei die Carboxylatgruppierung von Asp189 in der Substratbindungstasche eine starke elektrostatische Bindung mit den positiv geladenen Arg- und Lys-Resten eingeht. An der Spaltung der Arg/Lys-Xaa-Bindung sind die stark konservierten Reste Ser195, His57 und Asp102 beteiligt. Im Acylierungsschritt wird das Carbonyl-C-Atom der zu hydrolysierenden Peptidbindung vom Hydroxyl-Sauerstoffatom des Ser195 nucleophil angegriffen, wobei der Imidazolring von His57 als Protonenakzeptor fungiert (Abb. 1). Das resultierende Imidazolium-Ion wird durch die Carboxylat-Gruppe von Asp102 stabilisiert. Die C-O-Bindung des Carbonyl-C-Atoms der Peptidbindung wird zur Einfachbindung und das O-Atom erhält eine negative Ladung, wodurch sich ein tetraedrischer Übergangszustand (Abb. 2) ausbildet. Im Zuge einer damit verbundenen Konformationsverzerrung kann der Carbonylsauerstoff der zu spaltenden Peptidbindung (Oxyanion) tiefer in das aktive Zentrum eindringen und wird im Oxyanionloch durch H-Brücken zu den Amidprotonen von Gly193 und Ser195 stabilisiert. Das tetraedrische Intermediat zerfällt unter Freisetzung des neuen N-Terminus des gespaltenen Peptids in das Acylenzym-Zwischenprodukt, das durch Wasser leicht hydrolysiert wird. Nach neueren Erkenntnissen wird die klassische Triade Ser195......His57......Asp102 durch eine Anordnung zweier katalytischer Diaden Ser195.....His57 und His57.....Asp102 ersetzt, in der die Position von Asp gegenüber Ser.....His variieren kann. Trypsinogen besitzt ebenso wie T. die katalytische Triade und eine Substratbindungstasche, die jedoch strukturell und funktionell von der des T. abweicht. Die Blockierung der intrinsischen katalytischen Aktivität des T. ist neben anderen Faktoren auf die Verzerrung von Gly193 im aktiven Zentrum zurückzuführen, so dass eine optimale Stabilisierung des Übergangszustandes über die erwähnten H-Brücken nicht erfolgen kann.
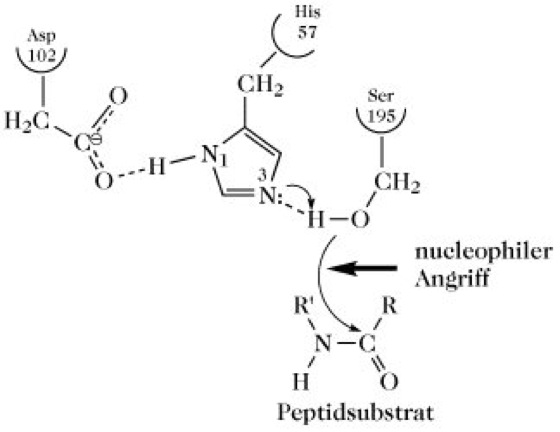
Trypsin. Abb. 1. Katalytische Triade im aktiven Zentrum des Trypsins.
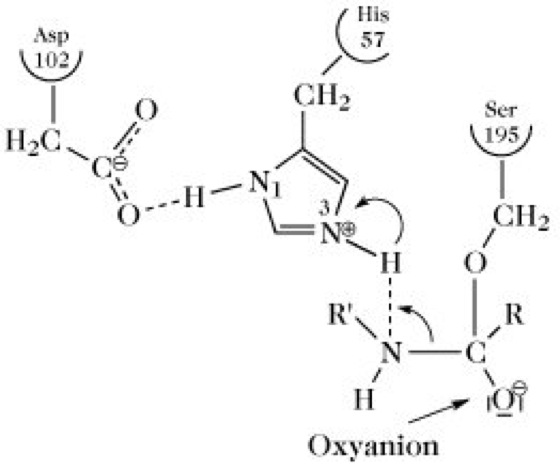
Trypsin. Abb. 2. Tetraedrisches Intermediat der Trypsinkatalyse.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.