Kompaktlexikon der Biologie: allosterische Regulation
allosterische Regulation, Form der Regulation der Enzymaktivität, die bei bestimmten, fast immer aus mehreren Untereinheiten zusammengesetzten Enzymen (allosterische Enzyme) vorkommt, die in mehr als einer stabilen Konformation der Gesamtstruktur vorliegen können. Die Um wandlung von einer zur anderen Konformation wird als allosterische Umwandlung oder allosterischer Effekt bezeichnet. Sie wird durch niedermolekulare Stoffe, die allosterischen Effektoren bewirkt, die nicht identisch mit dem Substrat des Enzyms sind und nicht im aktiven Zentrum des Enzyms binden (wie das Substrat), sondern an anderer Stelle, dem allosterischen Zentrum. Die dadurch bedingte Konformationsänderung des Enzyms bewirkt eine Aktivierung oder Inaktivierung des aktiven Zentrums und damit eine Aktivierung bzw. Hemmung des entsprechenden Enzyms (Vergleichbares gilt z.B.auch für Transportproteine oder Regulatorproteine). Die Aktivierung eines allosterischen Proteins durch einen allosterischen Effektor wird als allosterische Aktivierung oder positiver allosterischer Effekt bezeichnet, die Hemmung des Proteins durch einen allosterischen Effektor hingegen als allosterische Hemmung bzw. negativer allosterischer Effekt.
Allgemein können über allosterische Effekte die Aktivitäten von Proteinen (Enzymaktivitäten, Bindeaktivitäten von Transportproteinen oder Regulatorproteinen) durch Kleinmoleküle reguliert werden, die stereochemisch nicht mit den entsprechenden Substratmolekülen und damit auch nicht mit den entsprechenden aktiven Zentren der betreffenden Proteine verwandt sind. Allosterisch regulierte Proteine sind daher im Stoffwechsel der Zelle weit verbreitet und von großer Bedeutung ( vgl. Abb. ). Häufig katalysieren allosterische Enzyme den ersten Schritt einer Biosynthesekette und werden durch das Endprodukt der entsprechenden Biosynthesekette allosterisch gehemmt (allosterische Endprodukthemmung) ( vgl. Abb. ). Endprodukte paralleler Stoffwechselwege können dieser Hemmung entgegenwirken, indem sie als positive allosterische Effektoren die entsprechenden Enzymaktivitäten stimulieren. Ein durch Sauerstoffbindung an Hämoglobin induzierter allosterischer Effekt liegt z.B. dem Bohr-Effekt zugrunde. Bei Membranproteinen, z.B. der Adenylat-Cyclase konnten allosterische Umwandlungen beobachtet werden und bei der Regulation von Genaktivitäten (Genregulation) unterliegt die Bindestärke von Regulatorproteinen (Repressoren bzw. Aktivatoren) an die entsprechenden DNA-Signalstrukturen einer allosterischen Regulation. Im Unterschied zu isosterischen (normalen) Enzymen zeigen allosterische Enzyme eine s-förmige (sigmoidale) Substratsättigungskurve ( vgl. Abb. ). Da bei allosterischen Enzymen die Affinität des Enzyms zum Substrat nicht konstant, sondern von der Substratkonzentration abhängig ist, gibt man statt der Michaelis-Konstanten (Michaelis-Menten-Gleichung) die Substratkonzentration bei halbmaximaler Geschwindigkeit an.
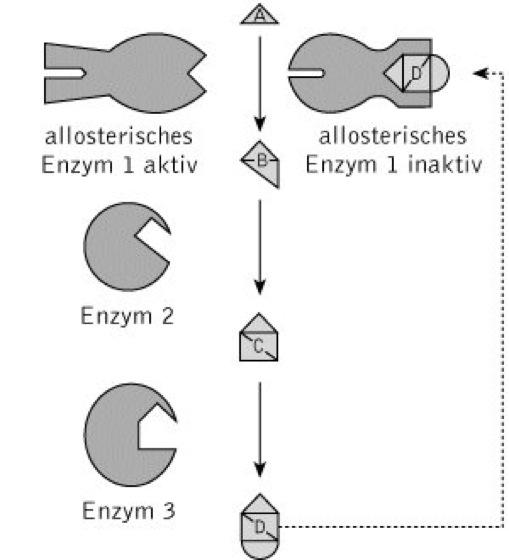
allosterische Regulation: Schema der allosterischen Endprodukthemmung. Das erste Enzym einer Reaktionskette, ein allosterisches Enzym, wird von dem Endprodukt der gesamten Reaktionskette gehemmt
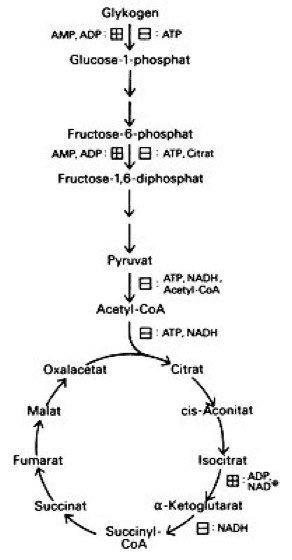
allosterische Regulation: Allosterische Regulationen im Energiestoffwechsel: Aktivierung (Plus-Zeichen im Kästchen) und Hemmung (Minus-Zeichen im Kästchen) von Reaktionsschritten durch ADP, NAD+ und ATP, NADH
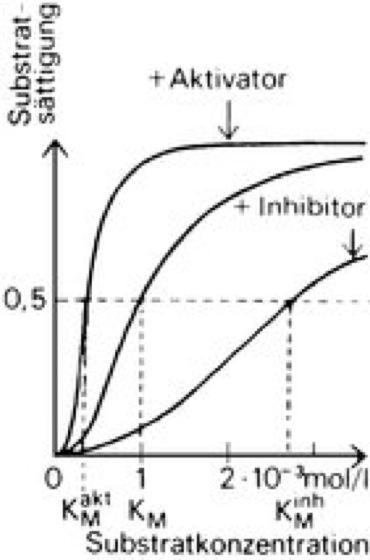
allosterische Regulation: Typische S-förmige Substratsättigungskurven nach Zugabe eines allosterischen Aktivators oder Inhibitors
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.