Kompaktlexikon der Biologie: Ribosomen
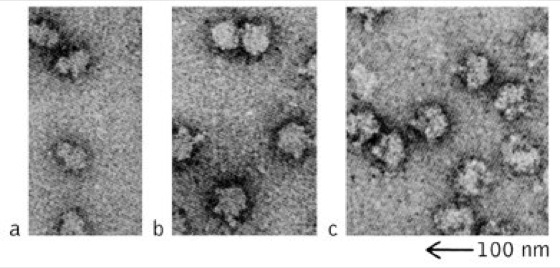
Ribosomen, die bei Prokaryoten und Eukaryoten sowie Mitochondrien und Plastiden in großer Anzahl vorkommenden Organellen, an denen die Proteinbiosynthese stattfindet (Translation). R. kommen sowohl frei im Cytoplasma als auch an der Außenseite des endoplasmatischen Reticulums vor (raues ER). Mit einem Durchmesser von ca. 25 nm sind R. große Ribonucleoprotein-Partikel, die in elektronenmikroskopischen Aufnahmen (Mikroskop) als gut kontrastierte Partikel erscheinen.
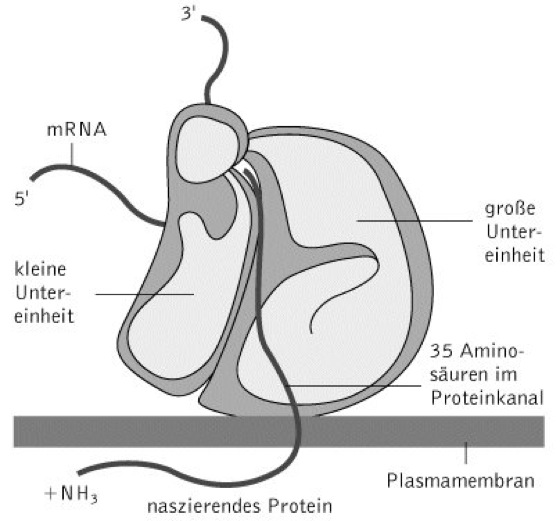
Aufbau. Ribosomen bestehen immer aus zwei Untereinheiten (UE), den so genannten kleinen UE und großen UE. Diese setzen sich wiederum aus ein bis drei Molekülen ribosomaler RNA (rRNA) und mehreren Proteinen zusammen. Zwischen Prokaryoten und Eukaryoten bestehen Unterschiede, was die Beschaffenheit der R. anbelangt. Prokaryotische R. werden nach ihrem Sedimentationskoeffizienten als 70S R. mit 50S- und 30S-UE, eukaryotische R. als 80S R. mit 60S- und 40S-UE bezeichnet ( vgl. Abb. ), ( vgl. Tab. ). Gemäß der Endosymbiontentheorie gehören die R. der Mitochondrien und Plastiden zum 70S-Typ. Bei Prokaryoten enthalten die großen ribosomalen UE zwei rRNAs, bei Eukaryoten und Plastiden drei rRNAs und bei Mitochondrien nur eine rRNA. Die kleinen UE bestehen stets nur aus einer rRNA. Was die Anzahl der Proteine anbelangt, bestehen zwischen den unterschiedlichen R.-Typen ebenfalls Unterschiede: eukaryotische R. enthalten in ihrer großen UE 40-45 Proteine (Prokaryoten: 33) und in ihrer kleinen UE 30-35 Proteine (Prokaryoten: 21). Ihre genaue Lage wurde durch immun-elektronenmikroskopische Verfahren bestimmt. Zwischen den rRNA-Molekülen und ribosomalen Proteinen bestehen keine kovalenten Bindungen, sondern nur elektrostatische und hydrophobe Wechselwirkungen. Eine Reihe von Untersuchungen deutet darauf hin, dass die beiden ribosomalen UE in ihrem Innern einen Raum bilden, in dem die Translation abläuft. Definierte Bindestellen sind für die mRNA, die mit einer Aminosäure beladene transfer-RNA (A-Bindungsstelle), das wachsende Polypeptid (P-Bindungsstelle) und die E-Stelle (Exit), über die die unbeladene tRNA das Ribosom verlässt.
R., die nicht an Translationsprozessen beteiligt sind, liegen im Cytoplasma in ihre Untereinheiten dissoziiert vor. Während des so genannten Ribosomenzyklus bindet zunächst die kleine UE an die messenger-RNA (mRNA), an die sich die Bindung der großen UE anschließt. Nach Beendigung der Translation lösen sich beide UE von der mRNA. Ihre Lebenszeit im Cytosol beträgt um die sechs Stunden. Da mRNA-Moleküle i.d.R. relativ lang sind, können Polysomen oder Polyribosomen vorliegen, bei denen mehrere R. hintereinander in einem mittleren Abstand von 100 Nucleotiden aufgereiht sind. Sie zeichnen sich durch eine schraubenförmige Struktur aus ( vgl. Abb. ). R. sind ihrer Funktion nach somit Multienzymkomplexe, die die einzelnen Schritte der Translation der Reihe nach katalysieren. Eine Reihe von Antibiotika hemmt bestimmte Translationsschritte, indem sie spezifisch an 70S- bzw. 80S-Ribosomen binden. Zu ihnen zählen Chloramphenicol, Cycloheximid, Puromycin und Streptomycin.


Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.