Kompaktlexikon der Biologie: Translation
Translation, Proteinsynthese, der sich während der Genexpression von Proteine codierenden Genen an die Transkription und Prozessierung der Primärtranskripte anschließende Prozess, bei dem die in der messenger-RNA (mRNA) als Abfolge von Nucleotiden („Basensequenz“) gespeicherte genetische Information umgesetzt wird. Die Synthese von Proteinen erfolgt vom Aminoterminus zum Carboxyterminus des jeweiligen Moleküls. Nach dem genetischen Code codieren jeweils drei Nucleotide für eine Aminosäure. Die T. erfolgt an den Ribosomen und lässt sich in drei Phasen unterteilen, wobei die Initiation mit der Positionierung des Startcodons (AUG) beginnt und dadurch die mRNA in Dreiereinheiten (Codons) festgelegt und somit das Leseraster bestimmt wird. Während der sich anschließenden Elongation findet eine schrittweise Verknüpfung von Aminosäuren unter gleichzeitiger Entstehung einer Polypeptidkette statt. Im Anschluss an ein Stoppcodon kommt es schließlich zur Termination der T. An allen drei Phasen sind sowohl bei Prokaryoten, als auch bei Eukaryoten eine Reihe von Proteinfaktoren beteiligt, die teilweise unter Hydrolyse von GTP Einzelschritte kontrollieren. Zwischen prokaryotischen und eukaryotischen Zellen bestehen mechanistisch gesehen keine Unterschiede in der T. Neben der Tatsache, dass sich beide Zellformen im Aufbau ihrer Ribosomen und in der Art und Weise der Genexpression unterscheiden (z.B. polycistronische Transkripte bei Prokaryoten, monocistronische Transkripte bei Eukaryoten), sind bei Eukaryoten teilweise wesentlich mehr Proteinfaktoren beteiligt. Die T. von für den Transport aus der Zelle bestimmten Proteinen erfolgt an Ribosomen des rauen endoplasmatischen Reticulums; cytoplasmatische Proteine, Kernproteine sowie Proteine weiterer Organellen werden i.d.R. an freien Ribosomen im Cytoplasma synthetisiert und posttranslational an ihren Zielort transportiert.
Initiation. Sie beginnt mit der Erkennung des Start-Codons, an der bei Prokaryoten neben der mRNA und der Initiations-tRNA (transfer-RNA) für Formyl-Methionin (fMet-tRNAfMet) drei Initiationsfaktoren (IF) und die kleine ribosomale Untereinheit (30S-UE) beteiligt sind. Dabei erfolgt die Bindung der mRNA an die kleine ribosomale UE über die Shine-Dalgarno-Sequenz. Der so entstandene 30S-Initiationskomplex bildet unter Anlagerung der großen ribosomalen UE anschließend den 70S-Initiationskomplex. Bei Eukaryoten erfolgt die Ribosomenbindung und Erkennung des Startcodons anhand der 7-Methylguanosin-Cap; hier ist die Initiations-tRNA auch nicht formyliert. ( vgl. Abb. )
Elongation. Während der Elongationsphase laufen mehrere Reaktionen (Aminoacyl-tRNA-Bindung, Peptidyltransfer, Translokation) zyklisch hintereinander ab. Die Ribosomen wandern dabei an der mRNA in 5'-3'-Richtung entlang und katalysieren die schrittweise Verknüpfung von Aminosäuren an wachsende Polypeptide. Zunächst bindet eine mit einer Aminosäure beladene tRNA, die Aminoacyl-tRNA (AA-tRNA) aufgrund ihres Anticodons an die Aminoacyl- oder Acceptor-Bindestelle (A-Stelle); diese Bindung erfolgt als ein ternärer Komplex der AA-tRNA mit einem Elongationsfaktor (EF) und GTP. Im Anschluss daran kommt es zur Übertragung der bereits bestehenden, als Peptidylrest bezeichneten Peptidkette von der sich in der P-Stelle (Peptidyl-Bindestelle) befindlichen Peptidyl-tRNA (PP-tRNA) auf die Aminoacylgruppe der AA-tRNA. Diese durch die Peptidyl-Transferase-Aktivität der Ribosomen katalysierte Reaktion führt somit zur Verlängerung des wachsenden Polypeptids um eine Aminosäure. Durch die sich anschließende Translokation des Ribosoms um drei Nucleotide gelangt die deacylierte tRNA in die E-Stelle (Exit) und löst sich vom Ribosom, um erneut mit einer Aminosäure beladen zu werden. Gleichzeitig wird die A-Stelle wieder frei, weil sich die verlängerte PP-tRNA nun in der P-Stelle befindet. An diesen Prozessen sind ebenfalls EFs beteiligt, die erforderliche Energie wird durch die Hydrolyse von GTP bereitgestellt. Die Geschwindigkeit der Elongation liegt pro Sekunde und Ribosom zwischen zehn und 20 Aminosäuren bei Prokaryoten und bei ca. zwei Aminosäuren bei Eukaryoten, wobei eine Fehlerrate von einer falsch eingebauten Aminosäure pro Tausend erzielt wird, die als ein evolutionärer Kompromiss zwischen Genauigkeit und Energieaufwand angesehen wird. ( vgl. Abb. )
Termination. Trifft ein sich an der mRNA entlang bewegendes Ribosom auf eines der drei Stoppcodons, kommt es zunächst zum Stillstand der T., da keine passenden tRNA-Moleküle vorhanden sind (Suppression). An ihre Stelle treten so genannte Terminations- oder Release-Faktoren (RFs), die an die A-Stelle binden und die Substratspezifität der Peptidyl-Transferase dahingehend verändern, dass ein Wassermolekül anstelle einer AA-tRNA aktiviert wird. Durch dessen nucleophilen Angriff auf die Bindung zwischen Peptidkette und tRNA kommt es schließlich zur Freisetzung des synthetisierten Proteins und zur Trennung der mRNA vom Ribosom, das wiederum in seine zwei Untereinheiten dissoziiert.
Die T. lässt sich durch Antibiotika inhibieren, die unterschiedliche Schritte der Proteinbiosynthese beeinflussen. So hemmt Streptomycin die Besetzung der A-Stelle, Tetracyclin die Besetzung von A- und P-Stelle, wohingegen der Peptidyltransfer bei Prokaryoten durch Chloramphenicol und bei Eukaryoten durch Cycloheximid gehemmt wird. Teilweise sind nur prokaryotische Systeme betroffen, was den Einsatz der Antibiotika als Medikamente erklärt.
Im Anschluss an die T. können Proteine eine Reihe von Modifikationen (z.B. Glykosylierungen) durchlaufen.

Translation: Schematische Darstellung der Initiationsphase bei Eukaryoten
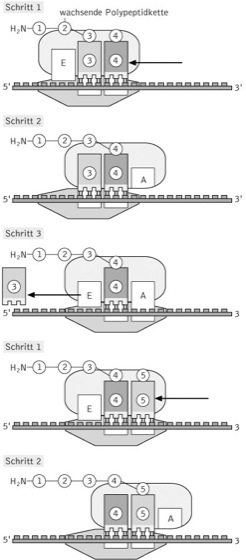
Translation: Der während der Elongationsphase auftretende Zyklus aus drei Schritten wird so lange wiederholt, bis das Ribosom auf eines der drei Stoppcodons trifft. Im 1. Schritt bindet die Aminoacyl-tRNA an die A-Stelle, im 2. Schritt wird eine Peptidbindung geknüpft unter gleichzeitiger Übertragung der wachsenden Peptidkette auf die gerade hinzugekommene tRNA, die im 3. Schritt nach der Translokation des Ribosoms um drei Nucleotide wieder freigesetzt wird. Die Translation erfolgt in 5'-3'-Richtung, wobei immer der N-Terminus des Proteins zuerst translatiert wird
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.