Lexikon der Biologie: Carotinoide
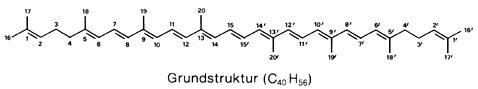
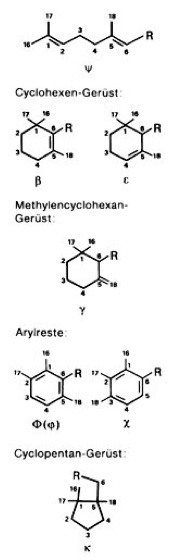
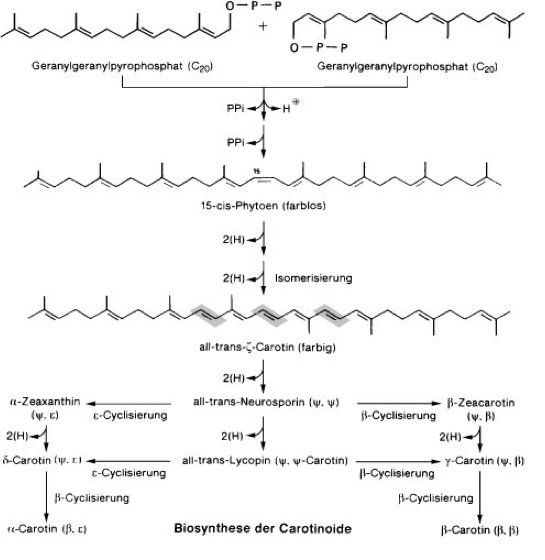
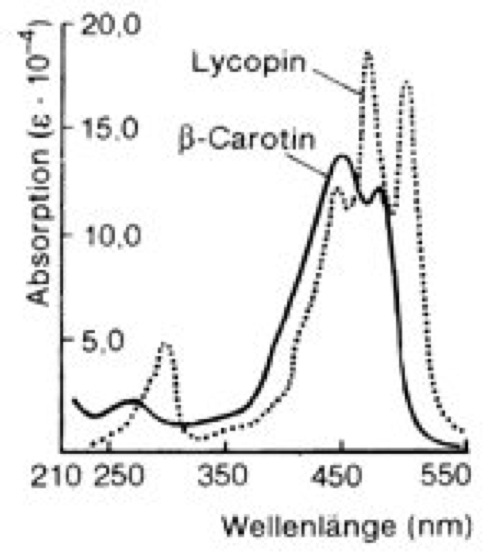
Carotinoide [Carotin], Karotinoide, Lipochrome, gelbe, rote oder purpurfarbene, im Pflanzen- und Tierreich weit verbreitete ( vgl. Tab. ), lipophile Pigmente (Polyen-Farbstoffe; Polyene), die meist aus 8 Prenyl-Einheiten aufgebaut sind und daher zur Klasse der Tetraterpene (C40-Körper; Terpene) zählen. Struktur und Nomenklatur: Die meisten Carotinoide lassen sich formal von dem acyclischen Lycopin C40H56 ( vgl. Abb. ) ableiten: 1) durch Cyclisierung einer oder beider Endgruppen ( vgl. Abb. ); die Struktur der Endgruppen wird durch zwei griechische Buchstaben vor der Stammbezeichnung des Carotinoids angegeben (z. B. ψ,ψ-Carotin, β,ψ-Carotin); Bezeichnungen wie Lycopin, β- und γ-Carotin usw. sind Trivialnamen. 2) Durch Hydrierung bzw. Dehydrierung abgeleitete Carotinoide erhalten das Präfix Hydro- bzw. Dehydro- (z. B. 3,4-Didehydro-ψ,ψ-carotin). 3) Durch Einbau von Sauerstoff lassen sich Alkohole, Aldehyde, Carbonsäuren, Ether, Oxirane usw. ableiten, wobei Carboxylgruppen verestert, alkoholische Gruppen mit Zuckern glykosidisch verbunden sein können usw. Im Gegensatz zu den nichtsauerstoffhaltigen Carotinoiden, die als Carotine bezeichnet werden, werden die sauerstoffhaltigen Derivate Xanthophylle genannt. Die entsprechenden Prä- und Suffixe sind Hydro- (z. B. Zeaxanthin), Methoxy- (z. B. Spirilloxanthin), Glykosyloxy- (z. B. Myxoxanthophyll), Carboxy- (z. B. Torularhodin), Epoxi- (z. B. Antheraxanthin, Violaxanthin) usw. 4) Carotinoide mit verkürzter Kette (weniger als 40 C-Atome) erhalten die Vorsilbe Apo- (z. B. Crocetin: 8,8´-Diapocarotin-8,8´-disäure), Seco- oder Nor- (z. B. Peridinin), während Carotinoide, die durch Kettenverlängerung entstanden sind und 45 oder 50 C-Atome besitzen, als mono- oder disubstituierte C40-Carotinoide behandelt werden (z. B. Decaprenoxanthin). 5) Bei Retro-Carotinoiden sind alle Einfach- bzw. Doppelbindungen um eine Position verschoben. 6) Ein oder mehrere Chiralitätszentren (Chiralität, optische Aktivität) im Molekül werden mit R,S-Symbolen vor dem Namen der Carotinoide gekennzeichnet (z. B. α-Carotin: (6´R)-β,ε-Carotin). 7) Abweichungen von der all-trans-Konfiguration der Grundstruktur werden, wie z. B. beim 15-cis-Phytoen, angegeben. – Die Farbigkeit der Carotinoide, die wegen ihrer Fettlöslichkeit auch Lipochrome genannt werden, beruht auf dem System mehrerer konjugierter Doppelbindungen (Konjugation), durch welche je nach Anzahl und Lage der Doppelbindungen Licht der Wellenlängen bis über 500 nm absorbiert (Absorption) wird, meist mit mehreren Absorptionsmaxima ( vgl. Abb. ). Auch das Vorhandensein verschiedener Seitengruppen beeinflußt die Absorptionsmaxima. Biosynthese: Die Biosynthese der Carotinoide ( vgl. Abb. ) Höherer Pflanzen (in Pilzen und Bakterien werden Carotinoide vermutlich auf ähnlichem Wege aufgebaut) verläuft innerhalb der Chloroplasten bzw. Chromoplasten und zunächst gemeinsam mit der Synthese anderer Isoprenoide (Steroide und Terpene) aus 3-Isopentenylpyrophosphat (C5, "aktives Isopren"), wobei sich Geranylpyrophosphat (C10), Farnesylpyrophosphat (C15, Abzweigung zu den Steroiden) und Geranylgeranylpyrophosphat (C20) als Zwischenprodukte bilden (Isoprenoide). Aus zwei Molekülen Geranylgeranylpyrophosphat wird das noch farblose 15-cis-Phytoen (C40) gebildet, das durch stufenweise Dehydrierung und durch Isomerisierung der 15-cis-Doppelbindung zunächst in all-trans-ζ-Carotin (farbig), weiter in all-trans-Neurosporin und schließlich in all-trans-Lycopin umgewandelt wird. Anschließende Cyclisierungsreaktionen ermöglichen die Bildung anderer Carotinoide, die ihrerseits Ausgangssubstanzen für die Vielzahl der Carotinoide sind. Xanthophylle werden aus Carotinen durch Einbau von Sauerstoff gebildet. Da nur unter bestimmten Bedingungen (z. B. Ergrünen von Keimlingen, Fruchtreifung) größere Mengen an Carotinoiden gebildet werden, muß eine Regulation der Biosynthese der Carotinoide erfolgen. Im Mycel des Pilzes Fusarium aquaeductuum ist die Biosynthese der Carotinoide durch Licht (Blaulicht, kurzwelliges Licht unter 520 nm Wellenlänge) induzierbar (Steuerung durch das Phytochrom-System), wobei als Ansatzpunkt der Photoregulation ein hinter Farnesylpyrophosphat liegender Reaktionsschritt (nach der Verzweigung zu den Steroiden) angenommen wird. Tierische Organismen können Carotinoide nicht selber synthetisieren. Sie können jedoch Carotinoide, die sie mit der Nahrung aufgenommen haben, umwandeln (z. B. Zeaxanthin in Astaxanthin). Vorkommen: Die Carotinoide Höherer Pflanzen (sie enthalten nur ψ-, β-, ε- und χ-Endgruppen!) kommen in Laubblättern (Blatt), Früchten (Frucht), Sproß (Sproßachse), Wurzeln, Antheren, Pollen und Samen vor und sind dort in den Plastiden (Chloroplasten und Chromoplasten) lokalisiert. Die Carotinoide der Thylakoidmembran in Chloroplasten grüner Laubblätter sind stets β-Carotin, Lutein, Violaxanthin und Neoxanthin. Ihre Farbe tritt im Herbstlaub hervor (Herbstfärbung), wenn im Verlauf der Seneszenz der Laubblätter das Chlorophyll verschwindet und die Chloroplasten in Chromoplasten umgewandelt werden. Ähnliches geschieht bei der Fruchtreifung (unreife, grüne Früchte besitzen dieselben Pigmente wie grüne Laubblätter; Fruchtreife), bei der die Umwandlung von Chloroplasten mit einer Synthese und Akkumulation von Carotinoiden einhergeht. Beispiele für Carotinoide in Früchten sind Lycopin (in Tomate und Hagebutte; Rose), Capsanthin (in rotem Pfeffer; Pfeffergewächse), β-Carotin, β-Kryptoxanthin und Zeaxanthin (in der Judenkirsche), Capsorubin (in Paprika) und β-Citraurin (in Citrus-Früchten). Die Carotinoide der Chromoplasten können membrangebunden, in Plastoglobuli (Lipidtropfen) oder als Kristalle vorliegen. Letztere entstehen bei starker Anreicherung der Carotinoide und können schließlich als "nackte" Carotin-Kristalle ins Cytoplasma ausgestoßen werden (z. B. Carotin-Kristalle im Speichergewebe der Mohrrübe; Möhre). Obwohl die gelbe bis rötliche Farbe von Blütenblättern (Blüte) meist auf Flavonoide (Anthocyane, Flavone) zurückzuführen ist, kommen vereinzelt auch Carotinoide als Blütenfarbstoff vor, z. B. Crocetin (in Crocus sativus;Krokus) und Violaxanthin (in Blüten von Arnika, Narzisse und Stiefmütterchen; Veilchen). In Samen findet man im allgemeinen nur wenige Carotinoide. Eine Ausnahme ist der Mais mit hohem Gehalt an β-Carotin, β-Kryptoxanthin und Zeaxanthin. Weit bekannt sind die Carotine (Carotin) von Daucus carota ssp. sativus (Karotte), nach denen die Carotinoide benannt wurden. Die Carotinoide der Algen (Tab.), aus deren charakteristischem Muster des Auftretens in den einzelnen Algenklassen sich ein Evolutionsschema aufstellen ließ, sind in Chromatophoren enthalten, die dadurch orange bis leuchtend rot gefärbt sind (z. B. Augenfleck von Euglena;Euglenophyceae). Auch Cyanobakterien (Blaualgen) besitzen Carotinoide, besonders β-Carotin. Bei Bakterien findet man eine Reihe von Carotinoiden mit ungewöhnlichen Strukturen, wie C45- und C50-Carotinoide, die fast ausschließlich in nichtphototrophen Bakterien vorkommen, methoxylierte Carotinoide, die nur in phototrophen Bakterien auftreten, sowie kohlenhydrathaltige, aromatische und Nor-Carotinoide und solche mit C≡C-Dreifachbindung und kumulierten Doppelbindungen. Die Carotinoide von Mensch und Tieren stammen alle aus pflanzlicher Nahrung und finden sich in Haut, Schale, Panzer, in Schnabel und Gefieder (Vogelfeder) von Vögeln, im Ei-Dotter (bei carotinoidfreiem Futter legen Hennen Eier mit fast farblosem Dotter; Hühnerei), in Milch und Butter, im Blutplasma, in den Keimdrüsen oder Gonaden (Gelbkörper) sowie in den Augenpigmenten. In der Forellenhaut (Forelle) findet man Carotinoide in Xanthophoren und Erythrophoren (Chromatophoren). Die rote Farbe von gekochtem Hummer ist auf das Carotinoid Astaxanthin zurückzuführen. Bedeutung und Funktion: Die Funktion der Carotinoide hängt mit ihrer Fähigkeit zur Lichtabsorption im Blau- und UV-Bereich (Ultraviolett) des Spektrums zusammen. In photosynthetischen Systemen liegt neben der Lichtabsorption in den Antennenkomplexen die Hauptaufgabe der Carotinoide in dem Schutz gegen Sauerstoffradikale, die entstehen können, wenn bei der Photosynthese die Energie des angeregten Chlorophylls nicht schnell genug weitergeleitet wird. Das angeregte Chlorophyll kann in seinem Triplettzustand die Energie auf Sauerstoff übertragen, der dann als Singulettsauerstoff extrem reaktiv ist und Proteine zerstören kann. Die Carotinoide leiten die überschüssige Lichtenergie durch Umwandlung in Wärme ab. Ein für die Photoprotektion wesentlicher Mechanismus ist der "Epoxidzyklus" der Xanthophylle (Xantophyllzyklus). Durch diesen Schutzmechanismus wird bei starker Belichtung aus Violaxanthin durch Deepoxidation über Antheraxanthin Zeaxanthin gebildet, das wesentlich effizienter mit Triplettchlorophyll reagieren kann. Hierdurch kann unter extremen Bedingungen bis zu 50% der absorbierten Energie in Wärme umgewandelt werden. Auch in nicht-photosynthetischen Geweben Höherer Pflanzen, in Pilzen und nicht-photosynthetischen Bakterien dienen Carotinoide als Schirmpigmente. Der Xanthophyllzyklus wurde in allen aeroben photosynthetischen Geweben, außer bei Cyanobakterien und Rotalgen sowie photosynthetischen Bakterien, gefunden. Eine weitere mögliche Funktion ist die Beteiligung der Carotinoide an Phototropismus und Phototaxis. In Blütenblättern und Früchten haben Carotinoide als Lockfarben für Tiere Bedeutung. Sehr wichtig ist die biologische Funktion einiger Carotinoide als Provitamin (Carotin). Heute vielfach auch technisch hergestellte Carotinoide werden in medizinischen Präparaten als Vitamin-A-Vorstufen, als Nahrungsmittelfarbstoffe (Margarine, Butter, Käse, Fruchtsäfte; Lebensmittelzusatzstoffe), in der Kosmetik und als Futtermittelzusatz verwendet. Antennenpigmente, Bürzeldrüse, Euler-Chelpin (H.K.A.S. von), Farbe, Karrer (P.), Kuhn (R.J.), Naturfarbstoffe, Sporopollenine, Wackenroder (H.W.F.); Stoffwechsel.
E.R./J.I.
Lit.: Hühn, M.M.: Carotinoide in photosynthetisch aktiven Eukaryoten. Göttingen 1994. Karrer, P., Jucker, E.: Carotinoide. Basel 1948.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.