Lexikon der Biologie: Golgi-Apparat
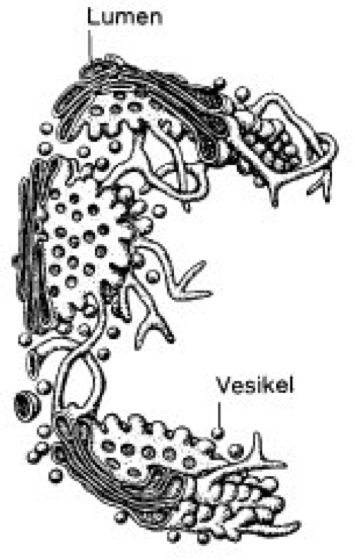
Golgi-Apparat [benannt nach C. Golgi], ein aus Stapeln schüsselförmiger Zisternen bestehendes Membransystem eukaryotischer Zellen (Eucyte), das normalerweise in der Nähe des Zellkerns gelegen ist ( vgl. Abb. 1 ). Die einzelnen Stapel mit einem Durchmesser von ca. 1 μm werden als Dictyosom, Golgi-Körper oder Golgi-Feld bezeichnet. Jeder besteht gewöhnlich aus etwa 6 Zisternen, in Zellen von Niederen Eukaryoten können es aber auch bis zu 30 sein. Die Anzahl der Dictyosomen pro Zelle variiert je nach Zelltyp sehr stark. In manchen Algenzellen besteht der Golgi-Apparat nur aus einem einzigen Dictyosom, ein Hepatocyt enthält etwa 250 Dictyosomen, pflanzliche Wurzelhaubenzellen mehrere hundert. Ob diese Dictyosomen alle gleichwertig sind, ist noch unklar. Die einzelnen, etwa 10–20 nm breiten Zisternen schnüren an ihren Rändern Vesikel (Golgi-Vesikel) unterschiedlicher Größe ab ( vgl. Abb. 2 ). In der Mehrzahl sind es kleinere Vesikel mit einem Durchmesser von ca. 50 nm, darunter auch COP-coated vesicles (coated vesicles), die für den Transport von Membranproteinen zwischen endoplasmatischem Reticulum und Golgi-Apparat verantwortlich sind. In auf Sekretion spezialisierten Zellen werden auch sehr große (Durchmesser 1000 nm) sekretorische Vesikel (auch sekretorische Granula oder Vakuolen genannt) von den Zisternen abgeschnürt. Neben den Exportproteinen (Exportproteinsynthese) passieren noch 2 weitere Gruppen von Proteinen den Golgi-Apparat: die löslichen Proteine der Lysosomen und die Membranproteine der intrazellulären Membranen und der Plasmamembran. –Polarität des Golgi-Apparats: Der Golgi-Apparat als „Durchgangs“-Kompartiment besitzt eine strukturelle Polarität: Die zum Zellkern hin orientierte oder an das endoplasmatische Reticulum angrenzende Seite wird als proximale, cis- oder Bildungsseite bezeichnet, die Gegenseite, in sekretorischen Zellen meist direkt an der Plasmamembran lokalisiert, ist die distale, trans- oder Sekretionsseite. Zwischen den cis- und trans-Zisternen befinden sich die medialen Zisternen. Wahrscheinlich gelangen die Proteine aus dem endoplasmatischen Reticulum auf der proximalen Seite in den Golgi-Apparat, werden auf dem Weg durch den Zisternenstapel verändert und werden auf der distalen Seite, verpackt in Vesikel, zu ihren verschiedenen Bestimmungsorten ausgeschleust. Die äußere, häufig gefensterte Zisterne, von der sich die Vesikel ablösen, wird auch als trans-Golgi-Netzwerk (TGN) bezeichnet (Adaptorproteine). Dort werden die Proteine auf die verschiedenen Transportvesikel verteilt und dann zu ihren endgültigen Bestimmungsorten gebracht – in die Plasmamembran, zu den Lysosomen oder zu sekretorischen Vesikeln. Der genaue Weg durch den Golgi-Apparat bzw. von Zisterne zu Zisterne innerhalb eines Stapels in allen Details wird noch diskutiert. Vermutlich fusionieren COPII-Vesikel (coated vesicles) miteinander und bilden eine neue cis-Zisterne. Die neue Zisterne wandert mit dem eingeschlossenen Material durch den Stapel. Als trans-Zisterne vesikuliert sie komplett zu Golgi-Vesikeln. Die beiden Seiten des Apparats sind biochemisch unterschiedlich. Die Membranen der proximalen Seite entsprechen in Dicke und Kontrastierbarkeit denen des endoplasmatischen Reticulums, an der distalen Seite sind sie dicker und dichter, vergleichbar der Plasmamembran. Bei der klassischen Golgi-Färbung werden hauptsächlich die beiden äußersten Zisternen der proximalen Seite gefärbt. Auch einige Enzymaktivitäten zeigen eine streng polare Lokalisation innerhalb des Golgi-Apparats: Enzyme für die ersten Verarbeitungsschritte befinden sich in den Zisternen nahe der cis-Seite des Golgi-Stapels, solche für spätere Verarbeitungsschritte in den Zisternen in der Nähe der trans-Seite (z.B. kommt die Thiaminpyrophosphatase nur in den Vesikeln der Sekretionsseite vor). – Durch die Kompartimentierung in verschiedene Zisternen ist der Golgi-Apparat bei Pflanzen in der Lage, mehrere Moleküle simultan zu verarbeiten, indem er die Moleküle in unterschiedlichen Zisternen lokalisiert. So werden z.B. Extensine in allen Zisternen gefunden, während Xyloglucan bevorzugt in den trans-Zisternen, Polygalacturonsäuren (Homogalacturonan) hingegen in den cis-Zisternen gelagert werden. Die abgeschnürten Vesikel enthalten jedoch meist nur eine Molekülsorte. Durch die räumliche Trennung der unterschiedlichen Glykosyl-Transferasen in verschiedenen Zisternen wird die Entstehung hybrider Polysaccharide verhindert. Im pflanzlichen Golgi-Apparat können Stoffe schon vor dem Erreichen der trans-Seite sekretiert werden. So verlassen z.B. Polygalacturonsäuren (Pektine) den Golgi-Apparat gleich nach der Prozessierung in den cis-Zisternen. Dies stellt einen Unterschied zum tierischen Golgi-Apparat dar, bei dem alle Stoffe erst auf der trans-Seite sekretiert werden.
Funktionen des Golgi-Apparats: Man kann den Golgi-Apparat als Hauptumschlagplatz der Zelle bezeichnen. Hier finden Anreicherung, kovalente Modifikation und Transport von Makromolekülen (Membrantransport) statt, die vom Golgi-Apparat aus zu ihren unterschiedlichen Bestimmungsorten dirigiert werden. In Pflanzenzellen ist eine Hauptfunktion des Golgi-Apparats die Synthese von Polysacchariden (Pektin und Hemicellulose), die dann über Golgi-Vesikel aus der Zelle transportiert und in die Zellwand eingebaut werden. Die kovalente Modifikation von Makromolekülen findet während ihres Transports durch die Zisternen des Golgi-Apparats statt. Hierzu gehört z.B. die spezifische Proteolyse: Bei vielen kleinen Peptidhormonen (Proinsulin, Proparathormon; Prä-Pro-Proteine) und sekretorischen Proteinen wie Proalbumin muß zunächst ein bestimmtes Teilpeptid abgespalten werden, bevor sie in ihrer endgültigen Struktur nach außen abgegeben werden. Ebenso kann ein Processing (Prozessierung) durch Anbindung von Sulfat- und Fettsäureresten stattfinden. – Bei der Glykosylierung von Proteinen (Glykoproteine) wird das im endoplasmatischen Reticulum an Asparagin (N-glykosidisch) ansynthetisierte Kern-Oligosaccharid (bestehend aus N-Acetylglucosamin und mehreren Einheiten Mannose) modifiziert. Ein Glykoprotein, das für die Lysosomen bestimmt ist, erhält eine Mannose-6-phosphat-Markierung im cis-Kompartiment des Golgi-Apparats. Bei Proteinen, die für sekretorische Vesikel oder für die Plasmamembran bestimmt sind, werden im cis-Kompartiment 3 Mannosereste von den Oligosaccharidketten solcher Proteine entfernt. Anschließend werden noch eine äußere Polysaccharidkette aus einer unterschiedlichen Anzahl von Trisacchariden und ein Fucoserest angeknüpft. Diese Reaktionen werden durch 3 verschiedene Glykosyl-Transferasen katalysiert, die strikt sequentiell arbeiten: die Zucker werden in der Reihenfolge N-Acetylglucosamin (im mittleren Golgi-Kompartiment) – Galactose – Sialinsäure (beide im trans-Kompartiment) ansynthetisiert (das Leitenzym für den Golgi-Apparat ist die Galactosyl-Transferase). Die äußere Seitenkette kann allerdings auch verkürzt sein und nur ein Disaccharid (N-Acetylglucosamin-Galactose) oder sogar nur N-Acetylglucosamin enthalten. Alle diese Reaktionen finden an der inneren Membranseite der 3 Kompartimente des Golgi-Apparats statt. Diese Kohlenhydratprozessierung im Golgi-Apparat wird als terminale Glykosylierung bezeichnet (im Gegensatz zur Core-Glykosylierung im endoplasmatischen Reticulum). – Von dieser N-Glykosylierung unterschieden wird die O-Glykosylierung. Diese beginnt posttranslational im endoplasmatischen Reticulum oder erst im Golgi-Apparat. Dabei wird zunächst ein GalNAc-Rest an die OH-Gruppe einer Aminosäure (Serin-, Threonin-, Hydroxylysin-, Hydroxyprolin-Reste) gebunden, weitere Zucker werden einzeln angefügt. – Nach ihrem Transport durch den Golgi-Apparat gelangen die Exportproteine in sogenannte kondensierende Vakuolen. Die konzentrierten Proteine werden dann in sekretorischen Vesikeln (Exocytosevesikel) zur Plasmamembran befördert, wo deren Inhalt durch Fusion der Vesikelmembran mit der Plasmamembran nach außen abgegeben wird. – Den Mechanismus der Sortierung der Proteine zu ihren jeweiligen Bestimmungsorten kennt man besonders gut bei Proteinen, die für das Lumen der Lysosomen bestimmt sind. Lysosomen-Hydrolasen werden im trans-Golgi-Netzwerk durch ein gebundenes Molekül Mannose-6-phosphat (M6P), das als topogenes Signal fungiert, markiert. Die M6P-Gruppen, die ausschließlich an die N-gekoppelten Oligosaccharide der löslichen Lysosomen-Enzyme angeheftet sind, werden von Transmembranproteinen des trans-Golgi-Netzwerks, den Mannose-6-phosphat-Rezeptoren, erkannt. Diese Rezeptoren binden spezifisch die M6P-markierten Enzyme und helfen bei der Verpackung in spezifische Transportvesikel, die ihren Inhalt an die späten Endosomen (Endosom) und damit an die Lysosomen abgeben. Der Rezeptor wird anschließend mit den leeren Vesikeln wieder zum trans-Golgi-Netz transportiert. Die Abgabe der Lysosomen-Hydrolase ist abhängig vom jeweiligen pH-Wert: Das M6P-Rezeptorprotein bindet bei pH 7 im trans-Golgi-Netzwerk das Oligosaccharid und setzt es im Innern des späten Endosoms bei pH 6 wieder frei. So ist der Transport des Enzyms in einer Richtung gewährleistet. Cytoplasma, Endocytose, Membranfluß; Zelle.
K.A./S.Kl.
Golgi-Apparat
Abb. 1: Räumliches Bild des Golgi-Apparats, wie er sich bei elektronenmikroskopischen Aufnahmen von tierischen Zellen darstellt.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.