Lexikon der Biologie: Proteinkristallisation
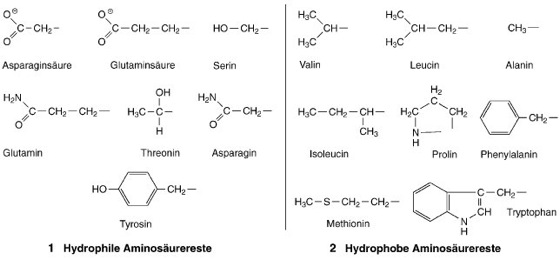
Proteinkristallisation. Genaue Kenntnisse über Wechselwirkungen zwischen Funktion und Struktur (Struktur-Funktion-Beziehung) von Biomolekülen sind für das Verständnis lebender Systeme (Leben) ebenso wie für die medizinische (Medizin) und pharmazeutische Forschung (Pharmazie) von fundamentaler Bedeutung. Die zuverlässigste Methode zur Aufklärung dreidimensionaler Molekularstrukturen stellt die Röntgenstrukturanalyse dar. Grundvoraussetzung für die Anwendung dieses Verfahrens ist die Verfügbarkeit geeigneter Einkristalle des zu untersuchenden Materials. Die Kristalle müssen von ausreichender Größe (0,5–1 mm) und guter Qualität (keine Verwachsungen oder Gitterversetzungen) sein. Da sich die Untersuchungen im wesentlichen mit makromolekularen Substanzen (Proteine, Nucleinsäuren und deren Derivate; Biopolymere) befassen, wobei Proteine wegen ihrer enzymatischen Eigenschaften (Enzyme) die dominierende Rolle spielen, bleibt die Einkristallzüchtung solcher komplexer Verbindungen das Hauptproblem einer Strukturuntersuchung und stellt meist den geschwindigkeitsbestimmenden Schritt des Verfahrens dar. Die relativen Molekülmassen von Proteinen liegen etwa zwischen 5000 und 1.000000. Es handelt sich dabei um Polypeptidketten mit exakt festgelegter Sequenz (Primärstruktur) der die Kette aufbauenden Aminosäuren (Peptidbindung). Die Natur bedient sich dabei 20 verschiedener Aminosäuren. Intramolekulare Wechselwirkungskräfte (chemische Bindung), insbesondere Wasserstoffbrücken, weniger ausgeprägt auch Disulfidbindungen, erzeugen innerhalb einer Kette teilweise Helikalbereiche (Sekundärstruktur; Helixstruktur) bzw. führen zur Verknäuelung der Kette (Tertiärstruktur). Alle Moleküle ein und desselben Proteins sind strukturell identisch. Proteine sind, von Ausnahmen wie z.B Membranproteinen abgesehen, wasserlöslich (Wasser). Die Wasser-Löslichkeit ist auf Wechselwirkungen der hydrophilen, an der Oberfläche des Proteinmoleküls befindlichen Aminosäurereste ( vgl. Abb. 1 und vgl. Abb. 2 ) mit den das Molekül umgebenden Wassermolekülen zurückzuführen. Diese Stabilisierung läßt sich durch Zugabe geeigneter wasserlöslicher proteinausdrängender Substanzen ( vgl. Tab. ) stören, und das Protein flockt dann, sofern die Prozedur rasch ausgeführt wird, als schwerlöslicher amorpher Niederschlag aus der Lösung aus. Als präzipitierend (ausfällend; Fällung) wirkende Reagenzien benutzt man anorganische Salze oder organische Verbindungen ( vgl. Tab. ). – Im Gegensatz zur nutzlosen Präzipitation hat man bei der Kristallisation von Proteinen darauf zu achten, daß die Ausdrängung des Proteins aus der Lösung extrem langsam erfolgt, damit die Moleküle ausreichend Zeit finden, sich dreidimensional periodisch translatorisch zu einem Kristallverband zu ordnen. Die Kraftfelder um jedes einzelne Molekül sind stark anisotrop (Anisotropie) und die Kräfte oft entgegengesetzt ausgerichtet. Intermolekular werden die Gitterbausteine des Kristalls im wesentlichen durch Dispersionskräfte und Coulomb-Wechselwirkungen stabilisiert und zusammengehalten. Jedes Molekül trägt elektrische Ladungen ( vgl. Abb. 3 ), deren Anzahl und Vorzeichen vom jeweiligen pH-Wert der wäßrigen Lösung abhängig sind. Am isoelektrischen Punkt, ein für jede Proteinsorte stoffspezifischer pH-Wert (Proteine [Abb.]), enthält ein Proteinmolekül gleichviele positive wie negative Ladungen (Zwitterion), d.h., bei Anlegen eines äußeren elektrischen Feldes wandert das Molekül weder zur Kathode noch zur Anode. Mit Zunahme des pH-Werts – vom isoelektrischen Punkt aus betrachtet – verschwinden die positiven Ladungen immer mehr, und die negativen nehmen zu: der anionische Charakter (Anion) des Moleküls verstärkt sich. Umgekehrt nehmen die positiven Ladungen und somit der kationische Charakter (Kation) des Proteinmoleküls mit abnehmendem pH-Wert zu. Es ist plausibel, daß gleichnamig geladene Teilchen sich wegen ihrer gegenseitigen Abstoßung nicht zu einem Gitterverband vereinen können. Die Einhaltung eines bestimmten optimalen pH-Werts ist deshalb bei Proteinkristallisationen, neben vielen anderen Parametern, von großer Bedeutung. Theoretisch gesehen stellt der isoelektrische Punkt die beste Bedingung für erfolgreiche Kristallisationen dar. Wegen Überlagerung mit weiteren Effekten ist dies aber oftmals nicht zutreffend: ein Proteinmolekül enthält nicht nur hydrophile, d.h. wasseraffine („wasserliebende“) Bereiche, sondern auch hydrophobe, wasserabstoßende Domänen ( vgl. Abb. 1 , vgl. Abb. 2 und vgl. Abb. 3 ). Wenn sich nun mehrere Moleküle zu einem Keim, dem Informationsträger des späteren Einkristalls, verbinden, so wären die günstigsten energetischen Voraussetzungen dann gegeben, wenn intermolekular negative mit positiven Ladungen und gleichzeitig hydrophobe mit hydrophoben und hydrophile mit hydrophilen Bereichen in Kontakt kommen würden. Diese beiden Domänen, Ladungen einerseits und hydrophile sowie hydrophobe Bereiche andererseits, sind zwar von Molekül zu Molekül identisch angeordnet, haben aber von ihrem physikalischen Gehalt her nichts miteinander zu tun. Auf jedem Molekül sind sie unabhängig voneinander an bestimmte räumliche Positionen fixiert. Deshalb kann bei der gegenseitigen Annäherung zweier Moleküle der obengenannte ideale Grenzzustand (Überlappung gleichartiger Bereiche bei gleichzeitiger Ladungskompensation) nie eintreten, d.h., die Realität liegt irgendwo zwischen diesem Idealzustand und dem ungünstigsten Grenzzustand (plus kontaktiert mit plus, minus mit minus und hydrophob mit hydrophil): jedes Molekül muß deshalb bei seiner Einordnung in den Kristallverband seine energetisch günstigste Lage suchen. Aus diesem Grund benötigt – im Gegensatz zu einer einfachen und rasch verlaufenden Kristallisation einer anorganischen Verbindung, wie z.B. Natriumchlorid (mit einfachsten Teilchen alternierender elektrischer Ladungen bei überdies isotroper Verteilung jeder Ladung) – der dreidimensional periodisch translatorische Aufbau eines Proteinkristallgitters Zeiten von Wochen, oft Monaten. – Voraussagen über beste Kristallisationsbedingungen bei Proteinen lassen sich nicht machen, da jede Substanz ihre eigene spezifische Sequenz und Struktur aufweist. Sie sind immer an Vorversuche gebunden. Die wichtigsten der zu variierenden und nur durch Ausprobieren zu optimierenden Parameter sind zahlreich: pH-Wert, Art der Pufferlösung (Puffer), Proteinkonzentration, Art des solubilisierenden Detergens bei Membranproteinen, Art und Konzentration der Präzipitationsverbindung, Ionenstärke (falls ein Salz als proteinausdrängendes Agens benutzt wird) und Temperatur. Außerdem ist ein höchstmöglicher Reinheitsgrad aller verwendeten Substanzen, insbesondere des zu kristallisierenden Proteins, Grundvoraussetzung für eine erfolgreiche Kristallzüchtung. Die Kombinationsmöglichkeiten der mannigfaltigen Variablen erfordern meist Hunderte, oft Tausende von Einzelexperimenten, aus denen dann schließlich rein empirisch die beste Kristallisationsvorschrift abgeleitet werden kann – und es wundert nicht, wenn die Proteinkristallisation aus all diesen Gründen dann und wann der Kunst und nicht der Wissenschaft zugeschrieben wird. – Vor der Inangriffnahme von Versuchsreihen ist darauf zu achten, daß alle zum Einsatz kommenden Lösungen optisch rein sind. Die Anwesenheit von Fremdpartikeln, z.B. Staubfasern, Luftbläschen, Fäden von bereits ausgeflocktem Protein usw., beeinflussen die Kristallisation durch Multikeimbildung negativ: in deren Anwesenheit bilden sich dann meist sehr viele kleine Kristallite statt, wie gewünscht, wenige und dafür große Kristalle. Am einfachsten und wirkungsvollsten läßt sich die optische Reinheit über Tyndall-Streuung (Tyndall-Effekt) mittels Laserlicht (Laser) überprüfen. Als Ausgangssubstanzen für das „Screening“, d.h. für das Aufsuchen der besten Kristallisationsbedingungen innerhalb sehr vieler Versuchsreihen, verwendet man im allgemeinen 2 Stammlösungen von relativ hoher Konzentration: eine Proteinlösung und eine Lösung mit dem Präzipitationsmittel. Beide Lösungen sind auf denselben pH-Wert abgepuffert. Die gewünschten Einzelansätze werden dann durch entsprechende Verdünnung der Stammlösungen mit Pufferlösung eingestellt. – Proteine, immer aus biologischem Material frisch isoliert (gelagerte Proteine zersetzen sich zunehmend), sind meist sehr kostbare Substanzen und stehen fast immer in nur geringer Menge zur Verfügung. Aus diesem Grund ist man beim materialaufwendigen Screening wegen dessen mannigfachen Variationsmöglichkeiten auf Mikromethoden angewiesen. Zunächst stellt man durch einige grob orientierende Vorversuche fest, wo die ungefähre Sättigungsgrenze des zu kristallisierenden Proteins liegt, weil sich Kristallisationsprozesse grundsätzlich in diesem Bereich abspielen. Dazu genügt es, einen Tropfen Proteinlösung vorgegebener Konzentration auf einem Objektträger unter dem Mikroskop solange mit zunehmender Menge an Präzipitationslösung (ebenfalls bekannter Konzentration) zu versetzen, bis das Protein auszuflocken beginnt. Aus den Gesamtvolumina der aufgetragenen Tröpfchen lassen sich dann Sättigungs- und Übersättigungsbedingungen abschätzen, und man kann danach mit dem Feinscreening, d.h. mit dem Screening innerhalb enger Grenzen um den Sättigungspunkt herum, beginnen. Als theoretisch bester Bereich für die Keimbildung wird eine extrem schwache Übersättigung eingestellt. Das anschließende Kristallwachstum dagegen hat im sog. Ostwald-Miers-Gebiet (Bereich zwischen Sättigungs- und Übersättigungskurve) zu erfolgen. Unterschreitet man den Sättigungsbereich, dann lösen sich die Kristalle wieder auf. – Den apparativen Versuchsdurchführungen für die Kristallzüchtung liegen verschiedene physikalische Prinzipien zugrunde: 1) Direkte Zugabe des präzipitierend wirkenden Agens zur Proteinlösung. Dieses Verfahren kann sowohl im Mikromaßstab auf Objektträgern, wie bereits oben beschrieben, als auch, sofern genügend Protein vorhanden ist, in kleinen, speziellen Reagenzgläsern (ca. 3 mm Innendurchmesser und 20 mm Höhe) appliziert werden und ist unter der Bezeichnung batch method bekannt. Dabei werden die Proben verschiedener Konzentrationen auf Objektträger (1 Probe pro Träger) gegeben bzw. in die Gläschen gefüllt, nach außen hin abgeschlossen (Objektträger kommen in abgedichtete Petri-Schalen), über längere Zeit erschütterungsfrei stehengelassen und von Zeit zu Zeit beobachtet. 2) Diffusion über die Dampfphase. Die derzeit gängigste Methode für die Proteinkristallisation, einschließlich Screening, stellt die Dampfphasendiffusion dar. Ihr Prinzip ist schematisch in Abb. 4a dargestellt. Ein Tropfen mit dem zu kristallisierenden Protein wird mit Präzipitationssubstanz, z.B. Ammoniumsulfat, vorgesättigt und in die Eindellung eines als Träger dienenden Plexiglasstabs, der innerhalb eines Gefäßes fixiert ist, gegeben. Am Boden des Gefäßes befindet sich getrennt von der Probe als Reservoir eine Ammoniumsulfatlösung, deren Sättigung geringfügig höher ist als jene im Probetropfen. Die gesamte Anordnung ist möglichst klein dimensioniert, und das Gefäß wird nach der Beschickung oben dicht verschlossen. Unter diesen Bedingungen hat die konzentriertere Reservoirlösung die Tendenz, sich zu verdünnen: sie saugt Wasser über die Dampfphase aus dem Probetropfen an, d.h., die Salzkonzentration in der Probe erhöht sich im Lauf der Zeit mehr und mehr und drängt Protein langsam kristallin aus der Lösung aus. Die Geschwindigkeit des Prozesses kann über den gewählten Konzentrationsunterschied zwischen Reservoir und Tropfen gesteuert werden: je höher die Differenz, desto rascher erfolgt die Proteinausdrängung. Das Verfahren wird als sitting drop method in den Laboratorien angewandt. Zur Vereinfachung und Ermöglichung großer Screening-Serien sind die üblich verwendeten Gerätschaften modifiziert und die Einzelapparaturen zu ganzen Batterien zusammengeschaltet. Eine sehr gebräuchliche Variante dieses Prinzips ist die hanging drop method ( vgl. Abb. 4b ). Hierbei liegt der Probetropfen nicht auf einer Unterlage, sondern wird auf ein Glasplättchen aufgetragen, das dann, Tropfen nach unten über der Salzreservoirflüssigkeit hängend, gleichzeitig als Verschluß des Gefäßes dient. Durch diese Anordnung wird die Kontaktfläche zwischen Tropfen und Glas verkleinert, sofern das Glas vorher siliconisiert, d.h. mit einer wasserabweisenden Substanz behandelt wurde. Größter Nachteil dabei ist, daß nur sehr kleine Tropfen in dieser Position mechanisch stabil bleiben. Größere Tropfen als ca. 30 Mikroliter fallen aufgrund ihres Eigengewichts nach unten ab. Auch hier werden ganze Serien zu Batterien (meist 4×6 Gefäße pro Einheit) zusammengeschaltet und sind in dieser Art als Linbro-Platten im Handel erhältlich. 3) Direkte oder über eine semipermeable Membran erfolgende Eindiffusion der präzipitierend wirkenden Agenslösung in die Proteinlösung. Hier befindet sich die Proteinlösung in einer Glaskapillare (ca. 1–2 mm Innendurchmesser), die an der Unterseite mit einer semipermeablen, d.h. nur einseitig durchlässigen Membran verschlossen ist ( vgl. Abb. 5 ). Das Röhrchen wird senkrecht nach unten in die das Präzipitationsagens enthaltende Lösung getaucht und verbleibt in dieser Position. Die Moleküle bzw. Ionen der präzipitierenden Substanz diffundieren durch die Membran in die Proteinlösung ein, während die Proteinmoleküle wegen ihrer Größe nicht in entgegengesetzte Richtung diffundieren können. Bei Einhaltung günstigster Bedingungen kristallisiert das Protein nach einiger Zeit innerhalb der Kapillare aus. 4) Löslichkeitsabhängigkeit durch Temperaturänderung. Diese Methode nutzt die Temperaturabhängigkeit der Löslichkeit von Proteinen. Proteine zeigen, in Gegenwart von Salzen, meist retrogrades Löslichkeitsverhalten: sie sind bei tiefen Temperaturen löslicher als bei hohen. Als Temperaturintervall kommt etwa der Bereich zwischen 0 °C und 20 °C in Frage. Sättigt man z.B. eine Proteinlösung bei 10 °C durch Zugabe von Präzipitationslösung solange, bis eine leichte Trübung der Lösung eintritt (beginnende Präzipitation), dann klärt sich die Flüssigkeit bei Abkühlung um einige Grad wieder vollständig. Nun startet man den Kristallisationsvorgang bei der tieferen Temperatur erneut und unter Einhaltung eines flach steigenden Temperaturgradienten: bei sehr langsamem Temperaturanstieg oder -abfall kann der Kristallisationsprozeß wahlweise sehr genau gesteuert und – falls notwendig – rückgängig gemacht und neu gestartet werden. – Nach geglückter Kristallisation muß der Kristall für die unmittelbar darauffolgenden Röntgenuntersuchungen speziell vorbereitet und präpariert werden. Proteinkristalle enthalten im Durchschnitt 43% Wasser, das im Kristallgitter statistisch verteilt vorliegt. Deshalb ist das Material sehr zerbrechlich und verwittert beim Liegenlassen an Luft innerhalb weniger Minuten. Kristalle müssen sofort nach deren Isolierung in Glas- oder Quarzkapillaren (1–2 mm Durchmesser, 0,01 mm Wandstärke) mit etwas Mutterlauge zusammen überführt und die Kapillaren mit Wachs dicht versiegelt werden ( vgl. Abb. 6 ). In dieser Form stehen sie dann schlußendlich der Röntgenbelichtung zur Verfügung. – Zu Forschungen zur Proteinkristallisation unter den Bedingungen der Schwerelosigkeit (Gravitationsbiologie) vgl. Abb. 7 .
W.L.
Proteinkristallisation
Abb. 1, 2: hydrophile und hydrophobe Aminosäurereste

Proteinkristallisation
Abb. 3: Schematische Darstellung der Verteilung von hydrophilen (A) und hydrophoben (B) Domänen sowie der elektrischen Ladungen auf der Oberfläche eines Proteinmoleküls
Proteinkristallisation
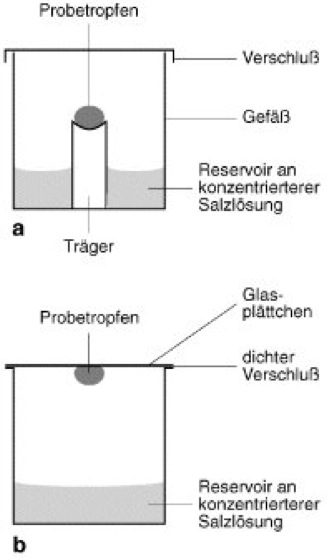
Abb. 4: Proteinkristallzüchtung über die Dampfphase; asitting drop method,bhanging drop method

Proteinkristallisation
Abb. 5: Proteinkristallzüchtung durch Diffusion

Proteinkristallisation
Abb. 6: In Glaskapillare (sog. Mark-Rohr) präparierter Einkristall für die Röntgenuntersuchung

Proteinkristallisation
Abb. 7: In den 1980er Jahren wurden Untersuchungen zur Proteinkristallisation unter den Bedingungen der Mikrogravitation („Schwerelosigkeit“) im Weltraum durchgeführt. So konnte erstmals während der „First Spacelab Mission“ FSLP (1983) nachgewiesen werden, daß schwerkraftgebundene Konvektion die Kristallisation von Proteinen negativ beeinflußt: im Spacelab gezüchtete Kristalle von Lysozym (a; durchschnittliche Größe 0,4 mm) und β-Galactosidase (b; durchschnittliche Länge der Nadeln 0,6 mm) waren, im Vergleich zum parallel auf der Erde durchgeführten Referenzexperiment, um ein Vielfaches größer und ihr Kristallhabitus qualitätsmäßig verbessert. Experimente mit zahlreichen anderen Proteinen und auch Viren (Satellit-Tabakmosaikvirus) haben, von einigen wenigen Ausnahmen abgesehen, diese Beobachtung bestätigt.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.