Lexikon der Chemie: Acetessigester
Acetessigester, Acetessigsäureethylester, CH3-CO-CH2-COOC2H5, eine farblose Flüssigkeit mit angenehmem Geruch; F. -45 °C (auch < -80 °C angegeben), Kp. 180,4 °C, nD20 1,4194. A. ist in Wasser schwer, in den meisten organischen Lösungsmitteln leicht löslich. Unter normalen Bedingungen liegt A., bedingt durch die Keto-Enol-Tautomerie, zu etwa 92,5 % in der Keto- und zu etwa 7,5 % in der Enolform vor: CH3-CO-CH2-COOC2H5![]()
CH3-C(OH)=CH-COOC2H5. Das Gemisch der beiden Komponenten kann durch fraktionierte Destillation in einer Quarzapparatur getrennt werden, wobei die leichter flüchtige Enolform (nD20 1,4432) als erste übergeht. Bei Einhaltung spezieller Trennbedingungen kann dabei die Ketoform (F. -39 °C, nD20 1,4171) ebenfalls in nahezu reiner Form erhalten werden. Aufgrund der Anwesenheit verschiedener funktioneller Gruppen im Molekül des A. ist dieser für zahlreiche Synthesen kettenförmiger und cyclischer Folgeprodukte verwendbar. Von besonderer Bedeutung sind die Acetessigestersynthesen und eine Reihe von Heterocyclensynthesen. A. ist eine schwache Säure, die mit Alkalihydroxiden oder -alkoholaten die entsprechenden Alkalisalze bildet:
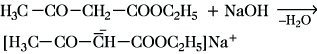
Das so gebildete Natriumsalz dient als Ausgangsverbindung für die präparativ wichtigen Acetessigestersynthesen. Bei der Umsetzung mit Alkylhalogeniden erfolgt der elektrophile Angriff am ambidenten Anion in den meisten Fällen am C-Atom, O-Alkylierungen werden seltener beobachtet:
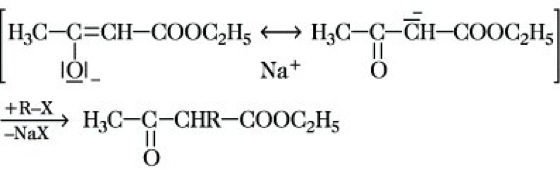
Durch Säurespaltung können die alkylierten A. in Umkehrung der Claisen-Kondensation in Essigsäure, Ethanol und in die entsprechend verlängerte Monocarbonsäure R-CH2-COOH zerlegt werden. Bei der Ketonspaltung entstehen die um R erweiterten Ketone CH3-CO-CH2-R Kohlendioxid und Ethanol. Durch Acylierung von A. können in Abhängigkeit von den Reaktionsbedingungen C-Acyl- bzw. O-Acylderivate erhalten werden:
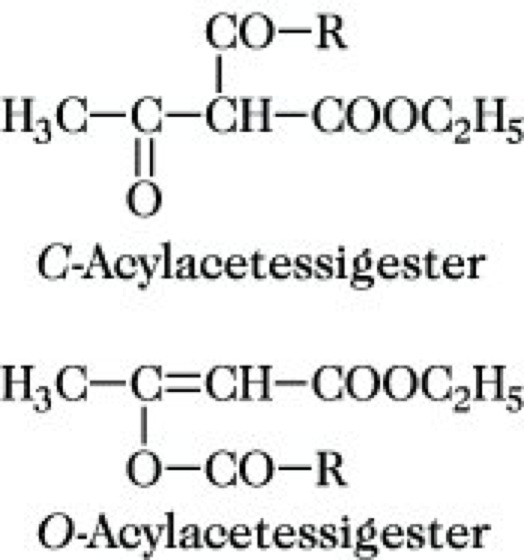
Anschließende Ketonspaltung der C-Acylderivate ermöglicht die Herstellung von β-Diketonen mit der allg. Formel CH3-CO-CH2-CO-R. Durch den Einsatz geeigneter Alkylierungs- und Acylierungsmittel sind damit auf der Basis von A. eine Vielzahl von Ketonen, β-Diketonen und Carbonsäuren präparativ einfach zugänglich. Die Herstellung von A. erfolgt durch Claisen-Kondensation von Essigsäureethylester oder durch Umsetzung von Diketen mit Ethanol.
A. wird als Zwischenprodukt zur Herstellung von Arzneimitteln, Farbstoffen und Pflanzenschutzmitteln sowie als Lösungsmittel und Riechstoffzusatz verwendet.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.