Lexikon der Chemie: Atomabsorptionsspektrometrie
Atomabsorptionsspektrometrie, Abk. AAS, Methode der Atomspektroskopie zur Einzelelementbestimmung vor allem von anorganischen Spuren- und Nebenbestandteilen.
Prinzip der Methode. Die A. nutzt das Absorptionsvermögen freier Atome zu ihrer quantitativen Bestimmung aus. Die freien Atome werden meist aus Lösungen auf thermischem Wege durch Verdampfen und Dissoziation in einem Absorptionsraum erzeugt. Dieser Absorptionsraum wird vom Licht einer speziellen Lichtquelle durchstrahlt. Die Änderung der Lichtintensität einer ausgewählten Linie wird in Form der Extinktion mit der Anzahl der Atome im Absorptionsraum und damit mit der Konzentration dieser Atome in der Probe in Beziehung gebracht.
Abb. 1 zeigt den schematischen Aufbau eines Atomabsorptionsspektrometers. Freie Atome werden im Atomisator erzeugt. Dazu ist Energiezufuhr erforderlich, die im allg. durch chem. Prozesse (Flammen) oder elektrische Widerstandserhitzung (Graphitrohrküvette, Quarzrohratomisator) aufgebracht wird. Im ersten Fall wird die gelöste Probe als Aerosol in eine Flamme gesprüht, die durch Verbrennung eines Ethin/Luft-Gemisches (erreichbare Temperaturen etwa 2500 K) sowie für schwerer verdampfbare Proben mit einem Ethin/N2O-Gemisch (3100 bis 3200 K) erzeugt werden.
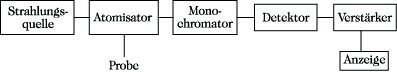
Atomabsorptionsspektrometrie. Abb. 1: Aufbau eines Atomabsorptionsspektrometers.
Neben dieser Flammen-A. ist auch die flammenlose A. weit verbreitet, die am häufigsten als elektrothermische Atomisierung in einer Graphitrohrküvette betrieben wird. Die Probe wird dazu meist in gelöster Form mit Hilfe einer Mikropipette in das Graphitrohr gebracht und mittels einer Widerstandsheizung sehr schnell auf 2000 bis 3000 K aufgeheizt. Über die Stufen der Trocknung und Veraschung erfolgt eine Atomisierung der Probe. Bei beiden Methoden reichen die Temperaturen nicht aus, um die in freier Form vorliegenden Atome in nennenswertem Maße anzuregen. Diese liegen ganz überwiegend im Grundzustand vor, wie aus der Tab. ersichtlich ist, in der das nach der Maxwell-Boltzmann-Verteilung berechnete Verhältnis von angeregten Atomen N zu Atomen im Grundzustand N0 für verschiedene Elemente und Temperaturen angegeben ist. Daraus lassen sich drei Vorteile der A. ableiten: 1) Da die beobachteten Absorptionsprozesse vom Grundzustand ausgehen, weisen sie eine hohe Intensität auf, die die Grundlage einer hohen analytischen Empfindlichkeit der Methode ist. 2) Da nur die Absorptionslinien beobachtet werden, die vom Grundzustand ausgehen, erhält man relativ linienarme Spektren, die wenig Überlagerungen der Spektrallinien aufweisen und sich somit durch eine hohe Selektivität auszeichnen. 3) Da die Anzahl der Atome im Grundzustand im vorliegenden Temperaturbereich sehr stark überwiegt und in erster Näherung als konstant angesehen werden kann, ist der Absorptionsprozeß im Gegensatz zum Emissionsprozeß weitgehend temperaturunabhängig.
Mit den bisher genannten Atomisierungsmethoden lassen sich feste Stoffe nur bedingt untersuchen. Mit speziellen Methoden, z. B. der Laser-Technik, wo mit Hilfe eines Laserstrahls Feststoffe in Mikromengen verdampft werden können, ist auch deren Untersuchung möglich. Als Strahlungsquellen werden in der A. spektrale Lichtquellen verwendet, deren Spektrallinien eine geringe Linienbreite und eine hohe Intensität aufweisen sollen. Diese Eigenschaften besitzen vor allem Hohlkathodenlampen (HKL). Eine HKL besteht aus einem Glaskörper, der mit einem Edelgas von 2,5 bis 5·102 Pa gefüllt ist und eine Kathode aus dem Material des zu bestimmenden Elementes in Form eines Hohlkörpers enthält (Abb. 2). Es ist für jedes Element eine gesonderte HKL erforderlich. Beim Anlegen einer Spannung setzt eine Glimmentladung ein. Es wird neben der charakteristischen Strahlung des verwendeten Edelgases die charakteristische Strahlung des Metalldampfes emittiert. Durch die Verminderung der Stoß- und Doppler-Verbreiterung (Linienbreite) sind die emittierten Linien sehr schmal und weisen eine geringere Linienbreite als die entsprechenden Absorptionslinien auf (Abb. 3).
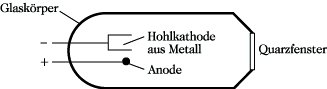
Atomabsorptionsspektrometrie. Abb. 2: Hohlkathodenlampe.
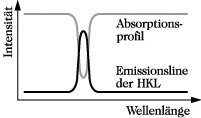
Atomabsorptionsspektrometrie. Abb. 3: Linienbreiten von Emissions- und Absorptionslinien
Atomabsorptionsspektrometrie. Tab.: Verhältnis N/N0 für die Resonanzlinien einiger Elemente
| ||||
| 2000 | 3000 | 4000 | 5000 | |
| Na 589,0 nm | 9,86 · 10-6 | 5,88 · 10-4 | 4,44 · 10-3 | 1,51 · 10-2 |
| Ca 422,7 nm | 1,21 · 10-7 | 3,69 · 10-5 | 6,03 · 10-4 | 3,33 · 10-3 |
| Zn 213,9 nm | 7,29 · 10-5 | 5,58 · 10-10 | 1,48 · 10-7 | 4,32 · 10-6 |
Durch diesen von Walsh 1955 erstmals angewandten Kunstgriff wird erreicht, daß die gesamte einfallende Strahlung absorbiert werden kann, was zu einer beträchtlichen Steigerung der Leistungsfähigkeit der Methode führte. Neben den HKL werden als Strahlungsquellen noch elektrodenlose Entladungslampen EDL (Abk. für engl. electrodeless discharge lamps) angewandt, in denen eine Anregung durch induktive Kopplung mit der Hochfrequenzenergie eines Senders erfolgt. Für den stattfindenden Absorptionsprozeß gilt eine dem Lambert-Beerschen Gesetz analoge Beziehung E = log I0/ID = k'N, wobei E die Extinktion, N die Anzahl der absorbierenden Teilchen und k' eine Konstante ist.
Da die von der Strahlungsquelle ausgesandte Strahlung mehrere Spektrallinien enthält, verwendet man einen Monochromator, der alle Linien bis auf die gewünschte aussondert. Meist verwendet man die Resonanzlinien der Elemente, die einem Übergang aus dem ersten angeregten Zustand in den Grundzustand entsprechen, zu ihrer Bestimmung. Da die wichtigsten Absorptionslinien der meisten Elemente im UV liegen, müssen optische Bauelemente aus Quarz angewendet werden. Die Intensitätsmessung des eingestrahlten und durchgelassenen Lichtes erfolgt durch Sekundärelektronenvervielfacher als Detektoren, die am Austrittsspalt des Monochromators angebracht sind. Das Lichtsignal wird dabei in ein elektrisches Signal verwandelt, das verstärkt und zur Anzeige gebracht wird.
Atomabsorptionsspektrometer können als Einstrahl- und als Zweistrahlgeräte gebaut werden (Spektralapparaturen). Einstrahlgeräte erfordern eine stabile Strahlung der Strahlungsquelle, während sich bei Zweistrahlgeräten Intensitätsschwankungen der Strahlungsquelle nicht auswirken. Um störende Eigenemissionen von Flammen und Atomisatoren zu eliminieren, moduliert man üblicherweise die Strahlung der HKL.
Die Auswertung der erhaltenen Ergebnisse kann nach dem Kalibrierkurvenverfahren erfolgen, nach dem die gemessene Extinktion E gegen die Konzentration c verschiedener Standards aufgetragen wird. Das Kalibrierkurvennerfahren weist jedoch häufig systematische Fehler auf. Die Richtigkeit der erhaltenen Ergebnisse kann durch Matrixeffekte beeinträchtigt werden. Im Falle der A. sind dies vor allem Einflüsse, die sich auf die Verdampfung und Dissoziation der Probe auswirken. Durch bestimmte Maßnahmen (z. B. Zusatz von Stoffen, die die störende Matrix binden, Änderung der Temperatur der Atomisierungsquelle) muß versucht werden, diese Effekte zu eliminieren. Matrixeffekte können teilweise korrigiert werden durch das Standard-Additionsverfahren, bei dem nach Zugabe von Standards zur Probe die Signalerhöhungen gemessen werden und so eine Kalibrierung in der jeweiligen Probenmatrix erfolgt. Matrixbedingte Störungen des spektralen Untergrundes können auch durch Untergrundkorrektur-Messungen beseitigt werden, vgl. Zeeman-Effekt.
Anwendung der A. Die A. hat sich in den letzten 25 Jahren zur wichtigsten Analysenmethode für die Bestimmung anorganischer Spuren- und Nebenbestandteile in Lösungen entwickelt. Durch die A. können etwa 70 Elemente des Periodensystems, vor allem Metalle und Halbmetalle, bestimmt werden. Die Bestimmung von Nichtmetallen ist oft problematisch, da die Resonanzlinien dieser Elemente meist unterhalb 200 nm liegen und eine Reihe von ihnen stabile, schwer dissoziierbare Moleküle bilden. Es können mit der A. sowohl Mikroproben als auch Makroproben analysiert werden, wobei für Mikroproben die elektrothermische Atomisierung in der Graphitrohrküvette besonders günstig ist. Bei dieser Technik treten keine Lösungsverluste wie in der Flamme auf. Die Verwendung von Lösungen bedingt, daß die Probe vorher aufgeschlossen werden muß. Die Einsatzmöglichkeiten der A. sind außerordentlich vielfältig. Sie spielt überall dort eine wichtige Rolle, wo anorganische, Komponenten analytisch zu bestimmen sind. Das ist auf zahlreichen Gebieten der Naturwissenschaften, Medizin und Technik, so z. B. in Biochemie, Toxikologie, Umweltschutz, Lebensmittelanalytik, Landwirtschaft und Metallurgie, der Fall.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.