Lexikon der Chemie: Benzol
Benzol, C6H6, die Stammverbindung der benzoiden aromatischen Kohlenwasserstoffe, Arene. B. ist eine farblose, brennbare und leicht entzündliche Flüssigkeit; es verbrennt mit stark rußender Flamme. Mit Wasser ist es praktisch nicht mischbar, dagegen unbegrenzt mit Ethanol und Ether. F. 5,5 °C, Kp. 80,1 °C, nD20 1,5011.
Vorkommen und Gewinnung. B. wurde früher hauptsächlich aus Steinkohlenteer oder Kokereigas durch Extraktion, Auswaschen und andere Trennprozesse gewonnen. Inzwischen werden seit vielen Jahren mehr als 90 % des für chemische Reaktionen benötigten B. aus der Erdölverarbeitung gewonnen (Alkanpyrolyse). Es fällt bei den verschiedensten Methoden der Benzingewinnung (Benzer) in großem Maßstab an.
|
Wegen seiner Toxizität ist die Verwendung als Lösungsmittel außerordentlich zurückgegangen.
Struktur. Erstmals isolierte 1825 Faraday B. aus Leuchtgas. Die Bruttoformel C6H6, die aufgrund herkömmlicher Vorstellungen nicht erklärt werden konnte, fand 1865 durch Kekulé von Stradonitz eine erste Deutung. Sie beinhaltet die völlige Gleichwertigkeit aller C- und H-Atome und erklärt, daß jeweils nur ein Monosubstitutionsprodukt existieren kann. Der Tatsache, daß nicht vier, sondern nur drei isomere Disubstitutionsprodukte vorkommen, trug Kekulé 1872 mit seiner Oszillationshypothese Rechnung, die besagt, daß ein ständiger schneller Wechsel zwischen den C-C-Einfach- und C=C-Doppelbindungen erfolgt, wodurch alle C-C-Bindungen gleichwertig sind:

Zahlreiche andere Formeln wurden zur Diskussion gestellt:

Den modernen Vorstellungen am nächsten kommen die Formeln von Thiele sowie Armstrong und Baeyer, während sich die anderen als falsch erwiesen. Einige von ihnen repräsentieren nicht-ebene Valenzisomere des B., die synthetisiert werden konnten (Dewar-B., Ladenburg-B., Hückel-B.).
Heute wird die Benzolformel für den praktischen Gebrauch meist durch eine der beiden Kekulé-Formeln oder auch durch eine der Thiele-Formel nahe kommende Variante dargestellt:

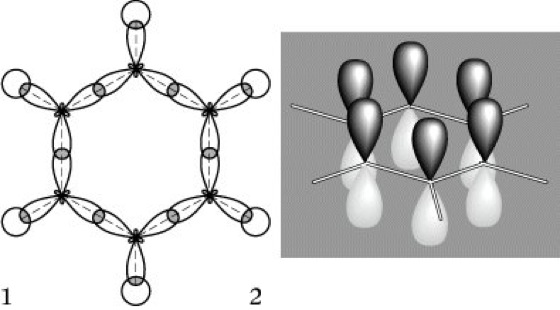
Das theoretische Verständnis des energiearmen, aromatischen Zustands des B. (Energiegewinn gegenüber dem nicht existierenden "Cyclohexatrien" von 150 kJ·mol-1), Aromatizität, kann durch mehrere Modelle unterstützt werden. Abb. 1 zeigt, daß alle sechs sp2-hybridisierten C-Atome und die sechs H-Atome in einer σ-Bindungsebene mit gleichen Bindungsabständen C-C und C-H liegen, d. h. eine hohe Symmetrie vorliegt. Abb. 2 zeigt die senkrecht zu dieser Ebene angeordneten π-Orbitale, die im realen Molekül optimal "überlappt" sind.
Reaktionen. B. wird durch katalytische Druckhydrierung zu Cyclohexan C6H12 und durch zahlreiche Substitutionsreaktionen mit bzw. ohne Katalysatoren, oder auch mit UV-Licht (Photoreaktionen) zu Derivaten wie Chlor-, Brom-, Nitrobenzole u. a. (Arene) umgesetzt. Die zweifache oder mehrfache Substitution und die Abwandlung der Produkte, z. B. die Hydrierung von Nitrobenzol zu Anilin, oder die Umsetzung von Brombenzol (Grignard-Reaktionen) zeigen, daß B. eine Schlüsselverbindung zur Synthese aromatischer Verbindungen ist.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.