Lexikon der Chemie: Calciumcarbid
Calciumcarbid, Calciumacetylid, meist Carbidgenannt, CaC2, farblose, tetragonale Kristalle; D. 2.22 g cm-3.
Eigenschaften. Das technische Produkt ist durch Verunreinigungen meist grau bis schwarz gefärbt. C. ist in organischen Lösungsmitteln unlöslich. Mit Wasser und verd. Säuren reagiert es bereits in der Kälte unter lebhafter Entwicklung von Ethin: CaC2 + 2 H2O → Ca(OH)2 + HC≡CH. In Sauerstoff verbrennt C. bei Rotglut zu Calciumcarbonat CaCO3. Elementarer Stickstoff wandelt C. in der Hitze in Kalkstickstoff um. Zahlreiche Metalloxide reagieren mit C. unter Bildung der entsprechenden Metalle oder Metallcarbide.
Herstellung. C. wird technisch in großem Umfange durch Umsetzung gebrannten Kalks mit Koks im Verhältnis 60 : 40 im elektrischen Widerstandsofen (Abb.) entsprechend folgender Gleichgewichtsbeziehung hergestellt: CaO + 3 C ![]()
CaC2 + CO, ΔH ≈ 460 kJ mol-1. Für die stark endotherme Reaktion ist erst bei sehr hoher Temperatur eine eindeutige Verschiebung der Gleichgewichtslage nach rechts zu erwarten. Unterhalb 1630 °C beobachtet man in reiner CO-Atmosphäre und einem Druck von etwa 0,1 MPa die rückläufige Reaktion. Andererseits reagiert C. bei sehr hoher Temperatur mit Calciumoxid CaO zu Calcium und Kohlenmonoxid CO. Man arbeitet deshalb üblicherweise bei etwa 2100 °C und erhält ein etwa 80 %iges Produkt, das noch 1 bis 2 % Kohlenstoff und 12 bis 15 % Calciumoxid enthält. Die Carbidöfen bestehen aus großen eisernen, mit Schamotte ausgemauerten Kästen, deren Böden und Wände mit Kohlestampfmasse ausgekleidet sind und eine Elektrode darstellen. Als Gegenelektrode dienen mehrere beweglich angeordnete Kohleelektroden (meist Söderberg-Elektroden). Der gesamte Ofen ist von einem wassergekühlten Stahlmantel umgeben. In modernen Anlagen kommen Hohlelektroden zum Einsatz, durch deren Hohlraum ein mit Koks- und Kalkfeinkorn beladener Kohlenmonoxidstrom eingeblasen wird. Das dünnflüssig anfallende C. wird von Zeit zu Zeit abgestochen. Nach dem Erkalten wird es gebrochen, gegebenenfalls gemahlen, und gelangt in dieser Form zur Weiterverarbeitung oder in luftdicht verschlossenen Trommeln mit 82 % CaC2-Gehalt in den Handel. Das Kohlenmonoxid wird einer Gasreinigung unterzogen und kann als Heizgas oder für Synthesen eingesetzt werden. Je Tonne C. werden 950 kg Kalk, 550 kg Koks, 20 kg Elektrodenmasse und 3100 kWh Elektroenergie benötigt. Aus Gründen des Umweltschutzes (Staubbelastung) geht man in allen Carbiderzeugungsanlagen zu voll geschlossenen Öfen über. Da der Energieverbrauch sehr hoch ist, bemüht man sich, Verfahren zu entwickeln, die ohne elektrische Energie arbeiten. So gelingt es z. B. durch Verbrennung eines Teiles des Koks mit reinem Sauerstoff, die zur Bildung von C. erforderliche Temperatur zu erhalten. Ferner kann man das C. durch Reduktion von Calciumphosphat, -sulfat oder -sulfid mit Kohle im elektrischen Ofen gewinnen.
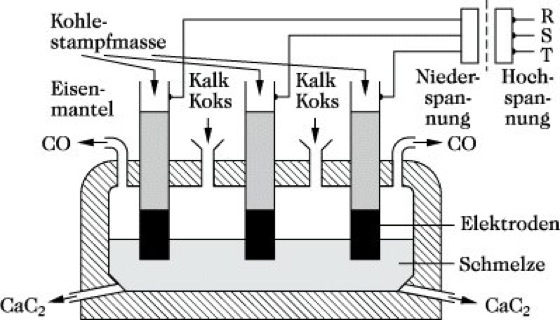
Calciumcarbid. Abb.: Carbidofen.
Verwendung. C. ist ein wichtiges Zwischenprodukt der chem. Industrie, dem angesichts der zu erwartenden Erdölverknappung sicher steigende Bedeutung zukommt. Es wird überwiegend zu Ethin, einem Basisprodukt der technischen Chemie, verarbeitet. Beträchtliche Mengen C. werden unmittelbar vom Verbraucher mit Wasser zu Ethin für Schweißzwecke zersetzt. International wird C. hauptsächlich zu Kalkstickstoff verarbeitet und zunehmend in der Metallurgie zur Entschwefelung eingesetzt.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.