Lexikon der Chemie: chemische Bindung
chemische Bindung, Art des Zusammenhalts von Atomen und Atomgruppen in Molekülen und Kristallen sowie an Grenzflächen. Die vorklassischen Theorien und Modelle der c. B. sind auf induktivem Wege entstanden und konnten die Kräfte nicht erklären, die Atome in einem Molekül zusammenhalten. Zur Angabe der Bindungsmöglichkeiten eines Atoms im Molekül wurde der Begriff der Wertigkeit geprägt, um die empirisch gefundene Zusammensetzung der Moleküle richtig wiedergeben zu können. Die klassischen Theorien der c. B. fußen auf dem Oktettprinzip, dem Bestreben jedes Atoms, sich mit 8 Valenzelektronen, d. h. mit 8 Elektronen auf der äußeren Schale, zu umgeben. Diese Elektronenkonfiguration wird als Edelgaskonfiguration bezeichnet und ist besonders stabil.
Atombindung (kovalente, homöopolare, unpolare Bindung, Elektronenpaarbindung). Bei der Atombindung wird nach den Vorstellungen von Lewis angenommen, daß jeweils zwei Atome ein oder mehrere Elektronenpaare gemeinsam nutzen (Bindungselektronenpaar) und somit häufig das angestrebte Elektronenoktett in der Valenzschale erreichen. Die Anzahl der gemeinsamen Elektronenpaare, d. h. die Anzahl der von einem Atom ausgehenden kovalenten Bindungen, wird Bindigkeit (Bindungswertigkeit) genannt. Ein Atompaar kann auch durch zwei oder drei gemeinsame Elektronenpaare verknüpft werden, wodurch Doppel- und Dreifachbindungen gebildet werden. In den Elektronenformeln werden die Valenzelektronen durch Punkte wiedergegeben:
In den übersichtlichen Valenzstrichformeln (nach Langmuir) kennzeichnen Striche zwischen Atomen Bindungselektronenpaare und Striche an Atomen einsame oder freie Elektronenpaare. Bindungs- und einsame Elektronenpaare werden möglichst so angeordnet, daß für jedes Atom ein Oktett resultiert, z. B.
Durch eine formale Zuordnung der Bindungselektronenpaare zu gleichen Teilen auf die jeweils aneinander gebundenen Atome erhält man aus der Differenz zwischen der auf diese Weise jedem Atom zukommenden Valenzelektronenzahl und der Rumpfladungszahl seine Formalladung. Sie sagt nichts über die wirkliche Ladungsverteilung in einem Molekül aus. So resultieren z. B. für Kohlenmonoxid in der Valenzstrichformel mit einer Dreifachbindung folgende Formalladungen |C- ≡O+|. Aus der Natur der Atombindung wird deutlich, daß es sich hierbei um gerichtet auftretende Bindungskräfte handelt, die niedrige Koordinationszahlen bedingen. Die Koordinationszahl eines Atoms oder Ions gibt die Zahl seiner nächsten Nachbarn an, z. B. sind in den Verbindungen N2, S8 (Achtring), P4 (Tetraeder) und {C} (Diamant) die Koordinationszahlen 1, 2, 3 und 4 realisiert. Das Elektronenpaar in einer Atombindung muß nicht notwendigerweise von verschiedenen Atomen stammen. Es ist auch möglich, daß beide Elektronen von einem Bindungspartner geliefert werden. Man bezeichnet dies als koordinative oder dative kovalente Bindung, z. B. H3N → BF3 oder H3N+ --BF3. Im wesentlichen ist sie mit einer normalen Atombindung identisch. Eine reine Atombindung liegt bei den zweiatomigen, homonuclearen Molekülen vor, da hierbei das Bindungselektronenpaar beiden Atomen in gleicher Weise angehört und somit kein Dipolmoment auftritt. Bei einer Verknüpfung von ungleichen Atomen wird ein Partner in stärkerem Maße das Bindungselektronenpaar anziehen und die Bindung wird polar. Die Polarität einer Bindung wird qualitativ durch die partielle Ladung δ, z. B.
gekennzeichnet. Sie ist die Ursache für das Auftreten eines Dipolmomentes bei zweiatomigen heteronuclearen Molekülen. Der Grenzfall, bei dem das Bindungselektronenpaar nur einem Partner angehört, führt zur Bildung von Ionen und würde der Ionenbindung (s. u.) entsprechen. Die Polarität einer Bindung kann durch die Elektronegativität der Bindungspartner abgeschätzt werden. Die Bindungsstärke erfolgt durch die Angabe der Bindungsenergie. Im Rahmen der klassischen Bindungstheorie basieren Aussagen über die Molekülgeometrie meist auf Modellvorstellungen (Elektronenpaar-Abstoßungsmodell). Eine quantitative Erklärung der Natur der c. B. und der Struktur der Moleküle ist erst auf quantenmechanischer Grundlage möglich (Molekülorbitaltheorie, Valenzstrukturtheorie).
Ionenbindung (heteropolare Bindung, Ionenbeziehung). Die Ionenbindung beruht auf der elektrostatischen Anziehung entgegengesetzt geladener Ionen. Ionen werden aus Atomen durch Abgabe bzw. Aufnahme von Elektronen gebildet und erreichen somit entsprechend dem Oktettprinzip eine stabile Edelgaskonfiguration (Kossel 1916). Zur Bildung von Kationen neigen besonders Elemente mit geringer Valenzelektronenzahl, z. B. Metalle, deren Ionisierungsenergie klein ist. Anionen werden bevorzugt von Atomen mit möglichst negativer Elektronenaffinität gebildet, z. B. von den Elementen der VI. und VII. Hauptgruppe des Periodensystems. Bei den komplizierten Kationen und Anionen können Metalle und Nichtmetalle als zentrale Atome auftreten: SO42-, MnO4-, NH4+, Cu(NH3)42+ (Koordinationschemie). Die Zahl der positiven bzw. negativen Elementarladungen eines Ions oder einer geladenen Atomgruppe wird als Ionenwertigkeit (Ionenladung, Ladungszahl) bezeichnet. So erreicht z. B. das Natriumatom durch Abgabe und das Fluoratom durch Aufnahme eines Elektrons die Elektronenkonfiguration des Neons bzw. Argons:
Die Wechselwirkung der kugelförmigen Ionen kann näherungsweise durch das Coulombsche Gesetz modelliert werden. Der Annäherung von ungleich geladenen Ionen sind Grenzen gesetzt, da neben der Coulombschen Anziehung (EAnz) eine repulsive Wechselwirkung erfolgt, die durch die gegenseitige Abstoßung der Elektronenhüllen bedingt ist (Abstoßungsenergie). Ein Ansatz zur näherungsweisen Berechnung der Abstoßungsenergie (EAbst) wurde von Born vorgeschlagen. Für die Gesamtwechselwirkungsenergie (EGes) eines Kations und eines Anions mit den Ladungszahlen z+ bzw. z- im Abstand R erhält man
EGes = EAnz + EAbst = 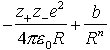
; hierbei ist e
Elementarladung, ε0 elektrische Feldkonstante, b stoffspezifische Konstante und n Bornscher Abstoßungsexponent. Da die Wechselwirkungskräfte der Ionen nach allen Richtungen des Raumes gleichermaßen wirken, stellt die Ionenbindung im Gegensatz zur Atombindung eine ungerichtete Bindung dar. Daraus resultieren hohe Koordinationszahlen, die im festen Zustand in Form eines neutralen Riesenmoleküls aus Anionen und Kationen, dem Ionenkristall, realisiert werden. Die Anordnung der Ionen im Ionenkristall erfolgt in der Weise, daß die Gesamtwechselwirkungsenergie möglichst einen minimalen Wert annimmt. Die Koordinationszahlen, der Abstand der Ionen im Gitter und damit der Gittertyp, sind wesentlich durch die Größe der Ionen (Radienquotient) sowie durch die Ladung bestimmt. Die Stabilität des Ionengitters wird durch die molare Gitterenergie charakterisiert.
Metallische Bindung. Diese ist der Bindungstyp von Metallen und Legierungen im festen oder flüssigen Aggregatzustand. Metalle sind Elemente mit nur wenigen s- und p-Valenzelektronen, die meist mit hohen Koordinationszahlen von 8 bis 12 kristallisieren und deren Zusammenhalt weder im Rahmen der Atom- noch der Ionenbindung erklärt werden kann. Zur näherungsweisen Beschreibung der besonderen Bindungsverhältnisse in Metallen wurde angenommen, daß die positiv geladenen Atomrümpfe ein Gitter bilden, das durch die frei beweglichen Valenzelektronen (Elektronengas) zusammengehalten wird. Mit Hilfe dieses um die Jahrhundertwende von Drude und Lorenz entwickelten Elektronengasmodells konnten die charakteristischen Eigenschaften der Metalle, z. B. der metallische Glanz, die hohe thermische und elektrische Leitfähigkeit und die Verformbarkeit, qualitativ erklärt werden. Der quantenmechanische Zugang zur metallischen Bindung erfolgt durch das Energiebändermodell.
Zwischenmolekulare Bindung (zwischenmolekulare Wechselwirkung). Die zwischenmolekulare Bindung beruht auf der Wechselwirkung zwischen valenzmäßig abgesättigten Einheiten. Im Gegensatz zu den bisher aufgeführten Bindungstypen handelt es sich hierbei um schwache Wechselwirkungskräfte, so daß man mitunter nur mit Einschränkungen von einer Bindung sprechen kann. Man unterscheidet Orientierungs-, Induktions- und Dispersionskräfte (van-der-Waalssche Bindungskräfte). Sie bewirken bei genügend tiefen Temperaturen oder hohem Druck die Aggregation von Atomen (Edelgase) und Molekülen im flüssigen und festen Zustand und sind für das Abweichen der Gase vom idealen Verhalten verantwortlich. Ein anderer Typ schwacher zwischenmolekularer Wechselwirkungen tritt bei Molekülen mit bestimmten charakteristischen Gruppen (z. B. -OH, -NH2) durch die Bildung von Wasserstoffbrückenbindungen auf, die die Eigenschaften dieser Stoffe wesentlich bestimmen.
Die aufgeführten Bindungsarten stellen Grenztypen der c. B. dar, die in den chemischen Stoffen in unterschiedlichen Kombinationen der genannten Bindungstypen vorliegen.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.