Lexikon der Chemie: Ester
Ester, Säurederivate, die durch Umsetzung von anorganischen Säuren oder von Carbonsäuren bzw. deren Derivaten (Säurechloride, Säureanhydride) mit Alkoholen oder Phenolen erhalten werden. Die E. von Carbonsäuren und deren Derivaten sind die Carbonsäureester. Aus mehrbasigen Säuren können neutrale E., z. B. Diethylsulfat, oder auch saure E., z. B. Oxalsäuremonomethylester, gebildet werden. Hydroxycarbonsäuren bilden innere E., die Lactone. Die E. der anorganischen Säuren werden durch Umsetzung dieser Säuren, ihrer Anhydride oder Halogenide mit Alkoholen gebildet. Die Alkylhalogenide sind als E. der Halogenwasserstoffsäuren aufzufassen, z. B. Methylchlorid oder Benzylchlorid, Alkylnitrate sind E. der Salpetersäure, z. B. Glycerintrinitrat (Trinitroglycerin), Alkylnitrite sind E. der salpetrigen Säure, Alkylsulfate und Dialkylsulfate sind saure bzw. neutrale E. der Schwefelsäure, z. B. Ethylsulfat bzw. Dimethylsulfat, die Trialkylphosphate sind neutrale E. der Phosphorsäure, Trialkylborate sind neutrale Borsäureester, z. B. Trimethylborat, und Tetraalkylsilicate sind neutrale E. der Kieselsäure. Die Carbonsäureester werden aus einer aliphatischen, aromatischen oder heterocyclischen Carbonsäure und einem Alkohol, Phenol oder einer heterocyclischen Hydroxyverbindung gebildet.
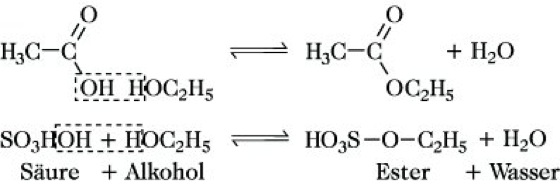
Die E. von Monocarbonsäuren sind im allg. wohlriechende (Fruchtester), flüssige oder feste Verbindungen, die unter anderem in ätherischen Ölen vorkommen. Die E. längerkettiger Monocarbonsäuren mit längerkettigen einwertigen Alkoholen sind die Wachse. Weitere natürlich vorkommende E. sind die Triacylglycerine längerkettiger, geradzahliger, gesättigter Fettsäuren (Palmitin-, Stearinsäure) und längerkettiger, geradzahliger, ungesättigter Fettsäuren (Öl-, Linol-, Linolensäure), die Fette und fetten Öle sowie die komplexen Lipide.
Bezeichnung. Die Namen der Ester setzen sich zusammen aus dem Namen der Carbonsäure und dem Namen des Kohlenwasserstoffrestes des Alkohols, dem Namen des Phenols oder dem Namen der heterocyclischen Hydroxyverbindung sowie dem Wort -ester, z. B. Essigsäureethylester. Eine andere, vorwiegend in der angelsächsischen Literatur übliche Art ist die Bezeichnung der E. als Alkyl- bzw. Arylcarboxylate, z. B. Ethylacetat.
Herstellung. Allgemeine Synthesemethoden für Carbonsäureester sind a) die Veresterung von Carbonsäuren mit Alkoholen, die nach einem AAc2-, in speziellen Fällen nach einem AAc1-Mechanismus abläuft. Die Veresterung mit tertiären Alkoholen folgt einem AA11-Mechanismus; b) die Acylierung von Alkoholen und Phenolen mit Carbonsäureanhydriden, Carbonsäurehalogeniden oder Monothiocarbonsäuren, die durch Basen, z. B. Pyridin, beschleunigt wird; c) die Umsetzung von Carboxylat-Ionen, insbesondere Silbersalzen von Carbonsäuren, mit Alkylhalogeniden; d) die Claisen-Reaktion; e) die Baeyer-Villiger-Oxidation; f) die Favorski-Umlagerung; g) die Addition von Carbonsäuren an Alkene bzw. Alkine (z. B. Herstellung von tert-Butylestern durch säurekatalysierte Addition von Carbonsäuren an Isobuten, Darstellung von Vinylestern); h) die Umsetzung von Carbonsäuren mit Diazoalkanen, z. B. die schonende Darstellung von Methylestern durch Umsetzung der Carbonsäuren mit Diazomethan in etherischer Lösung; i) die Umsetzung von Alkenen mit Kohlenmonoxid und Alkoholen in Gegenwart von konz. Schwefelsäure, z. B. die Darstellung von Ameisensäureestern durch katalytische Umsetzung von CO mit Alkoholen unter Druck; k) die Hydrolyse von Imidoestern; l) die Claisen-Kondensation.
Reaktionen. Wichtige Reaktionen der E. sind die säurekatalysierte Hydrolyse als Umkehrung der Veresterung, die nach den gleichen Mechanismen ablaufen wie die Veresterung, die basenkatalysierte Hydrolyse (Verseifung) zu Alkohol und Alkalisalz der Carbonsäure mit stöchiometrischen Mengen Base, die meist einem BAc2-Mechanismus folgt, die Umesterung oder Alkoholyse, bei der ein Alkoholrest durch einen anderen ersetzt wird, die Acidolyse zum Austausch des Carbonsäurerestes des E. durch einen anderen, die Aminolyse zur Darstellung von Säureamiden aus dem E. und Ammoniak, einem primären oder sekundären Amin, die Darstellung von Hydraziden bzw. Hydroxamsäuren aus E. und Hydrazin bzw. Hydroxylamin. Durch katalytische Hydrierung mit Kupfer(II)-oxid/Chrom(III)-oxid-Mischkatalysatoren, durch Bouveault-Blanc-Reduktion oder durch Reduktion mit LiAlH4 werden aus E. primäre Alkohole erhalten. Durch Umsetzung der E. mit Grignardverbindungen entstehen Ketone bzw. tertiäre Alkohole (Ameisensäureester ergeben mit Grignard-Verbindungen Aldehyde bzw. sekundäre Alkohole). Durch Acyloinkondensation von Carbonsäureestern unter inerten Bedingungen mit Natrium werden Acyloine erhalten. β-Ketoester unterliegen nach Alkylierung der Ketonspaltung oder der Säurespaltung.
Verwendung. Acetessigester ist Ausgangsstoff zur Synthese von Heterocyclen, Farbstoffen und Arzneimitteln. Durch Pyrolyse von Carbonsäureestern (Esterpyrolyse) werden Alkene bzw. Cycloalkene erhalten, analog reagieren Xanthogensäureester (Tschugaeff-Reaktion). Dicarbonsäureester werden für spezielle Synthesen verwendet, z. B. Malonsäureester für Malonestersynthesen, die Dieckmann-Kondensation und die Acyloinkondensation von Dicarbonsäureestern zur Darstellung mittlerer und großer alicyclischer Verbindungen. Außerdem dienen E. als Alkylierungsmittel (z. B. Alkylhalogenide, Dimethylsulfat), als Lösungsmittel für Lacke, Harze und Cellulosenitrat, als Extraktionsmittel, z. B. für Penicillin und für Phenole zur Abwasserreinigung, als Weichmacher (Phthalsäureester), als Kunststoffe und Lackrohrstoffe (Polyester, Celluloseester), als Synthesebausteine (Malonester, Acetessigester), als Geruchs- und Geschmackstoffe (Fruchtester). Salpetrigsäureester verwendet man als Zündbeschleuniger bei Dieselkraftstoffen (Ethylnitrit), in der Medizin als Heilmittel bei Angina pectoris (Isoamylnitrit), Salpetersäureester haben Bedeutung in der Sprengstoffindustrie (Glycerintrinitrat), Kieselsäureester dienen zur Herstellung von Siliconen, Phosphorsäureester werden als Insektizide verwendet.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.