Lexikon der Chemie: Extraktivdestillation
Extraktivdestillation, ein Verfahren der Destillation zur Trennung engsiedender Flüssigkeitsgemische mit Hilfe eines hochsiedenden selektiven Lösungsmittels. Die E. beruht darauf, daß die relative Flüchtigkeit der zu trennenden Komponenten durch das Lösungsmittel beeinflußt wird. Für die relative Flüchtigkeit eines realen Zweistoffgemisches gilt α = (fA/fB)·(pA/pB). Dabei bedeuten fA, fB Aktivitätskoeffizienten der Komponenten A und B sowie pA, pB Dampfdrücke der reinen Komponenten A und B. Durch den Zusatz des selektiven Lösungsmittels werden fA und fB so verändert, daß α wesentlich größer wird. Dadurch ist eine Destillation der Komponenten A und B möglich. Je nachdem, ob das selektive Lösungsmittel leichtflüchtig ist und mit der leichter flüchtigen Komponente A über Kopf destilliert oder ob es schwerflüchtig ist und im Sumpf der Kolonne verbleibt, spricht man von Azeotropdestillation oder von E. Die thermodynamischen Grundlagen sind für die E. und die Azeotropdestillation gleich. Der Dampfdruck des selektiven Lösungsmittels muß kleiner sein als der Dampfdruck der Komponenten des zu trennenden Gemisches.
Extraktivdestillation. Tab.: Technisch bedeutsame Extraktivdestillationsverfahren.
| ||||
| C4-Fraktion der Benzinpyrolyse | Butadien | Dimethylformamid N-Methylpyrrolidon Acetonitril Furfural Dimethylsulfoxid | Difex · · · · | |
| C5-Fraktion der Benzinpyrolyse | Isopren | Dimethylformamid N-Methylpyrrolidon | · · | |
| C6-Fraktion der Benzinpyrolyse | Benzol | Phenol N-Methylpyrrolidon N-Formylmorpholin | Distex Distapex Morphylan | |
| Isopropanol/Wasser Salzsäure/Wasser- Azeotrop | Wasser Wasser | Calciumchlorid/Wasser Schwefelsäure | · · |
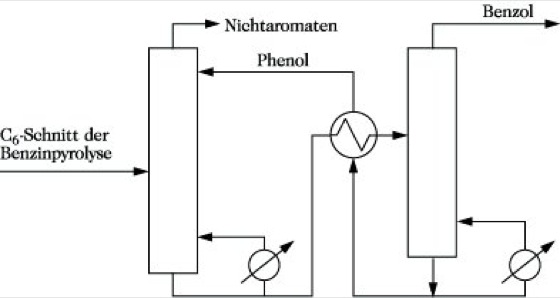
Extraktivdestillation. Abb.: Gewinnung von Benzol durch Extraktivdestillation nach dem Distex-Verfahren.
Die E. hat gegenüber der Azeotropdestillation den Vorteil, daß zahlreiche Lösungsmittel benutzt werden können, deren Flüchtigkeiten sich von denen der zu trennenden Komponenten stark unterscheiden. Auch die Konzentrationen des Lösungsmittels kann bei der E. sehr variabel sein. Das Lösungsmittel darf mit den Komponenten des Gemisches kein Azeotrop bilden und muß später wieder leicht abgetrennt werden können.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.