Lexikon der Chemie: Halogencarbonsäuren
Halogencarbonsäuren, Carbonsäuren, in deren Kohlenwasserstoffresten ein oder mehrere Wasserstoffatome durch Halogenatome ersetzt sind. Der Rest kann aliphatisch, aromatisch oder heterocyclisch sein. Die wichtigsten H. sind die mit einem gesättigten aliphatischen Rest und dem Halogenatom an dem C-Atom, das mit der Carboxygruppe verknüpft ist (α-H.). Sie werden als Halogenalkansäuren mit Angabe der Stellung des Halogenatoms bezeichnet. Wegen des -I-Effektes der Halogenatome sind die H. stärker sauer als die unsubstituierten Carbonsäuren, die C-X-Bindungen sind wegen des -I-Effektes der Carboxygruppe stärker polarisiert und daher reaktiver als in den Halogenalkanen. Allg. Darstellungsverfahren sind die direkte Halogenierung von Carbonsäuren mit Fluor, Chlor oder Brom und die Hell-Volhard-Zelinsky-Reaktion von Carbonsäurehalogeniden mit Chlor oder Brom. Während die Halogenierung der Carbonsäuren in Gegenwart starker Brönsted- oder Lewis-Säuren nach einem ionischen Mechanismus selektiv α-H. ergibt, werden unter radikalischen Reaktionsbedingungen Gemische von α-, β-, γ- und anderen H. in statistischer Verteilung erhalten. β-H. lassen sich gezielt durch Halogenwasserstoffaddition mit anti-Markownikoff-Orientierung aus α,β-ungesättigten Carbonsäuren erhalten. Halogensubstituierte Benzoesäuren sind durch elektrophile Halogensubstitution von Benzoesäure bzw. ihrer Derivate darstellbar. H. sind vielseitig verwendbare Syntheseausgangsstoffe. Die Hydrolyse führt in SN-Reaktionen zu Hydroxycarbonsäuren bzw. zu Lactonen. Bei α-H. wird in einer SN2-Reaktion unter Retention wegen Nachbargruppenbeteiligung der Carboxygruppe ein α-Lacton erhalten. Die Hydrolyse von β-H. und ihren Derivaten läuft meist nach einem Eliminierungs-Additions-Mechanismus ab, bei hohen Temperaturen bleibt die Reaktion auf der Stufe der α,β-ungesättigten Carbonsäuren stehen, oder es erfolgt in einer Konkurrenzreaktion eine heterolytische Fragmentierung:
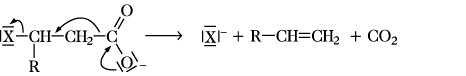
α-H. sind Ausgangsstoffe für die Reformatski-Reaktion zur Darstellung von β-Hydroxycarbonsäuren und für die Darzenssche Glycidestersynthese (Darzens-Erlenmeyer-Claisen-Kondensation). H. von Bedeutung sind die Chloressigsäure, Dichloressigsäure, Trichloressigsäure und Trifluoressigsäure.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.