Lexikon der Chemie: Ionisierung
Ionisierung, die vollständige Herauslösung eines Elektrons aus der Elektronenhülle eines Atoms oder Moleküls. Die Energie, die zum Abtrennen des Elektrons erforderlich ist, die Ionisierungsenergie, kann z. B. als thermische Energie, elektromagnetische Strahlung oder kinetische Energie zugeführt werden. Bei entsprechend hoher Energiezufuhr ist es möglich, von einem Kation weitere noch vorhandene Elektronen abzuspalten. Somit können hochgeladene positive Ionen An+ erzeugt werden: A ![]()
A+ + e-; A ![]()
A2+ + e-; A2+![]()
A3+ + e- usw. Die nach und nach zugeführten Energien werden als erste, zweite, dritte Ionisierungsenergie usw. bezeichnet. Die Ionisierungsenergien der Atome hängen in charakteristischer Weise von der Elektronenkonfiguration der Elemente ab. Die Abb. zeigt die ersten Ionisierungsenergien in Abhängigkeit von der Ordnungszahl des Elementes. Die Alkalimetalle haben die geringste Ionisierungsenergie, da sie durch Abtrennung ihres Valenzelektrons eine stabile Oktettschale erreichen. Sie neigen deshalb zur Bildung von Kationen und damit zur Ionenbindung. Die größten Ionisierungsenergien sind bei den Edelgasen zu beobachten. Die relativen Minima bei den Elementen der III. und VI. Hauptgruppe sind darauf zurückzuführen, daß durch die I. relativ stabile Elektronenkonfigurationen mit abgeschlossenen bzw. halbbesetzten Unterschalen resultieren.
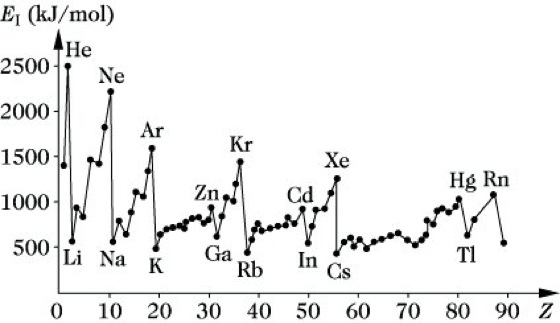
Ionisierung. Tab.: Abhängigkeit der ersten Ionisierungsenergie EI von der Ordnungszahl Z.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.