Lexikon der Chemie: Magnetochemie
Magnetochemie, ein Teilgebiet der Chemie, das den Zusammenhang zwischen den magnetischen Eigenschaften der Stoffe und ihrer Struktur untersucht. Die für die M. wichtigsten Eigenschaften sind Diamagnetismus und Paramagnetismus.

Magnetochemie. Abb. 1: Diamagnetische (a) und paramagnetische (b) Stoffe in einem homogenen Magnetfeld.
Entstehung von Dia- und Paramagnetismus. Bringt man einen Körper in ein homogenes Magnetfeld, so sind zwei Fälle möglich (Abb. 1): Entweder der Körper drängt die magnetischen Feldlinien in seinem Inneren auseinander (Diamagnetismus), oder der Körper verdichtet die Feldlinien in seinem Inneren (Paramagnetismus). Das Zustandekommen dieser magnetischen Eigenschaften kann man sich wie folgt erklären: Nähert man einem geschlossenen Leiter, wie es die Elektronenbahnen in den Atomen sind, den Pol eines Magneten, so wird in diesem Leiter durch Induktion ein Strom erzeugt, der die Stromstärke ändert, und zwar so, daß das durch diesen Induktionsstrom erzeugte Magnetfeld dem angelegten Magnetfeld entgegengerichtet ist (Abb. 2). Dies ist eine Erscheinung, die in der Elektrizitätslehre als Lenzsche Regel bekannt ist. Auf diese Weise heben sich die Feldlinien des äußeren und des induzierten Feldes im Inneren des Körpers teilweise auf, so daß sich insgesamt eine Verdünnung der Feldlinien ergibt. Der Körper ist diamagnetisch. Dieser diamagnetische Effekt tritt bei allen Stoffen auf und ist eine universelle Eigenschaft der Stoffe. Er ist temperaturunabhängig, da die Bewegung der Elektronen durch die Temperatur nicht beeinflußt wird. Diamagnetische Stoffe werden in inhomogenen Magnetfeldern in Bereiche geringerer Feldstärke gedrängt, also von den Polen abgestoßen.

Magnetochemie. Abb. 2: Induktionsstrom mit zugehörigem Magnetfeld.
Diesem diamagnetischen Effekt kann sich in gewissen Fällen ein zweiter paramagnetischer Effekt überlagern. Das ist dann der Fall, wenn die Atome oder Moleküle des betrachteten Stoffes nach außen hin ein permanentes magnetisches Moment aufweisen. Jedes in einem Atom oder Molekül kreisende Elektron gibt Anlaß zu einem Kreisstrom, mit dem ein magnetisches Moment verbunden ist. Im allg. heben sich aber die von den einzelnen Elektronen herrührenden Felder gegenseitig auf. Das ist immer dann der Fall, wenn in den Atomen bzw. Molekülen abgeschlossene Elektronenschalen vorliegen. Bei nicht abgeschlossenen Schalen können sich die magnetischen Momente nicht vollständig kompensieren, und die vorliegenden Atome, Ionen oder Moleküle weisen ein permanentes magnetisches Moment auf, sie stellen kleine Elementarmagnete dar. Diese Elementarmagnete sind ohne äußeres Magnetfeld infolge der Wärmebewegung regellos verteilt.
Legt man jedoch ein äußeres magnetisches Feld an, so richten sie sich aus, indem der Nordpol des Elementarmagneten sich dem Südpol des äußeren Magneten zukehrt und umgekehrt. Durch diese Ausrichtung entsteht ein zusätzliches Magnetfeld, das dem äußeren Feld gleichgerichtet ist. Die Zahl der magnetischen Feldlinien im Inneren des Körpers nimmt zu, der Körper ist paramagnetisch. Der Paramagnetismus ist im Gegensatz zum Diamagnetismus temperaturabhängig, da die Wärmebewegung der Einstellung der Elementarmagnete in Nord-Süd-Richtung entgegenwirkt. Der Richtungseffekt ist um so geringer, je höher die Temperatur ist. In inhomogenen Magnetfeldern werden paramagnetische Stoffe in Richtung wachsender Feldstärke gezogen.
Bestimmung magnetischer Eigenschaften. Die Proportionalitätskonstante zwischen der Feldänderung, die durch eine ins Magnetfeld eingebrachte Substanz ausgelöst wird, und des angelegten äußeren Feldes nennt man Suszeptibiliät Χ. Sie bezeichnet die Aufnahmefähigkeit eines Stoffes für magnetische Feldlinien. Diamagnetische Stoffe, die die Feldlinien in ihrem Inneren auseinanderdrängen, haben einen negativen Suszeptibilitätswert, paramagnetische Stoffe, die die Feldlinien verdichten, einen positiven. Mitunter wird anstelle der Suszeptibilität Χ die Permeabilität μ verwendet. Beide Größen sind durch die Beziehung μ = 1 + Χ verbunden. Für diamagnetische Stoffe gilt dann μ < 1, für paramagnetische μ >1. Eine Messung der Suszeptibilität kann mit Hilfe der magnetischen Waage erfolgen. Dabei wird die scheinbare Gewichtsveränderung eines Stoffes gemessen, wenn er in ein erzeugtes inhomogenes Magnetfeld hineingezogen (bei Paramagnetismus) oder abgestoßen (bei Diamagnetismus) wird.
Aussagemöglichkeiten diamagnetischer Messungen.Der Diamagnetismus einer Substanz ermöglicht zunächst den Schluß auf abgeschlossene Elektronenschalen. So findet man Diamagnetismus bei Edelgasen und den edelgasähnlichen Ionen wie Na+, Cl-, ferner bei allen Atomen und Ionen der Übergangsgruppen mit 18 Elektronen wie Pd, Cu+, Zn2+, die neben den s- und p-Bahnen noch vollbesetzte D-Niveaus haben, sowie schließlich bei allen Atomen und Ionen, die außerhalb eines Systems von abgeschlossenen Schalen nur 2 s Elektronen enthalten (z. B. Be, Zn, Ca). Nahezu alle organischen Moleküle sind diamagnetisch. Die Bedeutung der diamagnetischen Suszeptibilität für den Chemiker liegt vor allem darin begründet, daß sie sich für ein Molekül in erster Näherung additiv aus empirischen Einzelwerten (Inkrementen) für die Atome und gewisse Strukturelemente zusammensetzen läßt.
Aussagemöglichkeiten paramagnetischer Messungen. Während alle Stoffe ein diamagnetisches Verhalten zeigen, tritt Paramagnetismus nur dann auf, wenn sich die magnetischen Momente der Einzelelektronen nicht gegenseitig kompensieren können. Die molare Suszeptibilität Χmol eines paramagnetischen Stoffes setzt sich folglich aus 2 Anteilen zusammen, einem diamagnetischen und einem paramagnetischen: Χmol= Χdia+ Χpara.
Beide Anteile haben nicht nur unterschiedliches Vorzeichen, sondern unterscheiden sich auch in ihrer absoluten Größe, wobei paramagnetische Suszeptibilitäten um 1 bis 3 Zehnerpotenzen größer sind als die diamagnetischen. Das führt dazu, daß der Diamagnetismus vom Paramagnetismus – sofern vorhanden – stets überkompensiert wird. Beide Größen kann man dadurch trennen, daß man die diamagnetische Molsuszeptibilität mit Hilfe eines Inkrementsystems berechnet und von der gemessenen Gesamtsuszeptibilität abzieht, so daß die paramagnetisehe Molsuszeptibilität übrigbleibt. Die so ermittelten Χpara-Werte haben besonders für 2 Gebiete der Chemie Bedeutung: 1) die Koordinationschemie und 2) die Chemie der freien Radikale.
In der Koordinationschemie kann man aus der paramagnetischen Suszeptibilität oft die Elektronenanordnung des Zentralatoms und damit seine Wertigkeit bestimmen. Das spielt für Übergangsmetalle eine wichtige Rolle. Übergangsmetall-Kationen besitzen gewöhnlich mehr D-Orbitale, als für die Unterbringung ihrer D-Elektronen benötigt werden, so daß für letztere mehrere Anordnungen möglich sind, die sich in ihren magnetischen Momenten unterscheiden.
Man geht dabei so vor, daß man aus der gemessenen paramagnetischen Suszeptibilität Xpara gemäß der Gleichung
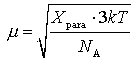
das magnetische Moment μ in Einheiten des Bohrschen Magnetons μB berechnet, wobei k die Boltzmann-konstante, T die absolute Temperatur und NAdie Avogadrosche Zahl bedeuten. Dieses magnetische Moment läßt sich im einfachsten Fall unter Vernachlässigung der Bahnmomente der Elektronen vorhersagen, wenn man die Anzahl der ungepaarten Elektronen n, die sich in Komplexen aus der Li- gandenfeldtheorie ableiten lassen, in die Gleichung
einsetzt. Die Zahlenwerte des magne-tischen Momentes in Abhängigkeit von n betragen:
n = 1 2 3 4 5
μ = 1,73 2,83 3,88 4,90 5,92 μB
Mit Hilfe paramagnetischer Messungen ist es möglich, die Existenz freier Radikale exakt nachzuweisen. So konnte die Existenz von Triphenylmethylradikalen in Lösung sowie der Triplettzustand des Sauerstoffmoleküls mit zwei parallelen Elektronenspins anhand ihres Paramagnetismus nachgewiesen werden. Mit der magnetischen Waage lassen sich allerdings nur stabile Radikale in relativ hohen Konzentrationen nachweisen, für geringe Radikalkonzentrationen bedient man sich besser der Elektronenresonanz-Spektroskopie.
Ferromagnetismus ist keine Eigenschaft von Atomen oder Molekülen, sondern eine Kristalleigenschaft, die durch Kopplung der atomaren Spinmomente in einem größeren Kristallbereich zustande kommen. Durch die Beteiligung vieler Elektronen entstehen beträchliche magnetische Momente, die sich zu einem äußeren Magnetfeld analog zu den paramagnetischen Momenten der Atome oder Moleküle orientieren können. Die ferromagnetische Suszeptibilität hat deshalb ebenso wie die paramagnetische ein positives Vorzeichen, weist aber einen erheblich größeren Wert auf.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.