Lexikon der Chemie: Naphthalin
Naphthalin, ein zu den Acenen gehörender kondensierter aromatischer Kohlenwasserstoff. N. kristallisiert in farblosen, rhombischen Blättchen, die einen charakteristischen Geruch (nach Mottenpulver) aufweisen; F. 80,6 °C, Kp. 218 °C, nD20 1,5898.
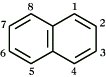
N. ist in Wasser unlöslich, aber wasserdampfflüchtig. Es ist leicht löslich in siedendem Ethanol, in Ether, Benzol und anderen organischen Lösungsmitteln. Es sublimiert und brennt mit leuchtender Flamme.
Im Ringsystem des N. kann formal nur für einen der beiden Ringe ein π-Elektronensextett formuliert werden. Der aromatische Charakter ist deshalb weniger ausgeprägt als beim Benzol. Der eine der beiden Ringe kann leicht mit naszierendem Wasserstoff zu 1,2- oder 1,4-Dihydronaphthalin oder zu 1,2,3,4-Tetrahydronaphthalin (Tetralin) hydriert werden. Die Oxidation mit Luft in Gegenwart von Vanadium(V)-oxid führt zu Phthalsäureanhydrid, die Umsetzung mit Chrom(VI)-oxid in Eisessig zu 1,4-Naphthochinon. Wie Benzol kann auch N. elektrophil substituiert werden. Die Erstsubstitution erfolgt in der Regel kinetisch kontrolliert und regioselektiv in 1-Position (α-Position). So entstehen z. B. bei der Chlorierung 95 % 1-Chlor- und nur 5 % 2-Chlornaphthalin. Bei der Nitrierung entsteht fast ausschließlich 1-Nitronaphthalin, und bei der Sulfonierung bildet sich unterhalb 80 °C als Hauptprodukt Naphthalin-1-sulfonsäure, oberhalb 120 °C vorrangig Naphthalin-2-sulfonsäure. Beide Säuren gehen bei energischer Umsetzung mit Schwefelsäure in Naphthalin-1,5- und -1,6-disulfonsäure bzw. in Naphthalin-2,6- und -2,7-disulfonsäure über, die als Zwischenprodukte für die Azofarbstoffindustrie von großer technischer Bedeutung sind. Naphthalinsulfonsäuren werden durch Alkalischmelze in Naphthole überführt.
N. kommt in geringen Mengen in einigen Erdölsorten vor. Es ist Bestandteil des Steinkohlenteers und wird daraus auch heute noch technisch gewonnen. Synthetisch ist es aus Benzol und Bernsteinsäureanhydrid über zahlreiche Zwischenprodukte zugänglich. Diese Synthese hat jedoch keine technische Bedeutung.
N. wird in großem Maßstab zur Herstellung von Phthalsäureanhydrid, als Ausgangsstoff für Farbstoffe, Arzneimittel und Gerbstoffe verwendet. Außerdem dient es als Insektizid.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.